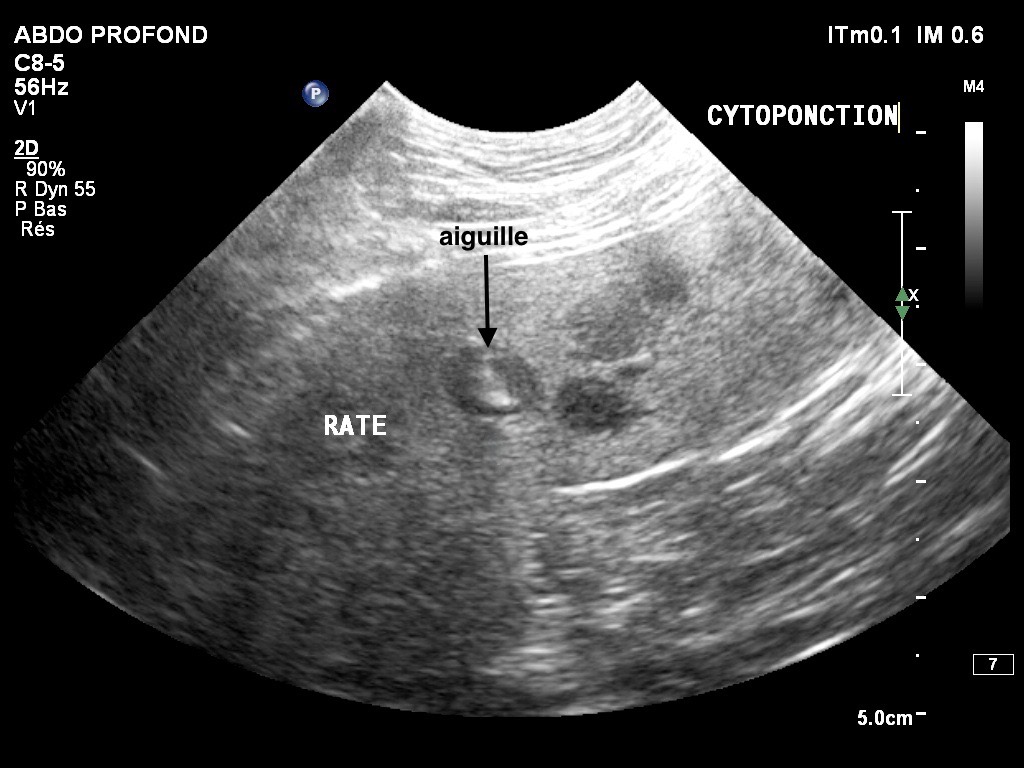
Maladie régionale par excellence, la leishmaniose canine est due à des protozoaires flagellés, appartenant au genre Leishmania (L. infantum dans le sud de la France), et transmis par la piqûre d’un petit moucheron : le phlébotome. Les leishmanies ont été décrites pour la première fois en France à Marseille, en 1913 chez le chien, et en 1922 chez l’Homme.
Une maladie présente depuis aussi longtemps dans les villages entourant nos cliniques de Calvisson (Gard), et surtout de Villevieille-Sommières (Gard, limitrophe de l’Hérault), suscite bien sûr bon nombre de questions… et aussi quelques fantasmes. Nous avons donc choisi de faire figurer ici un article très détaillé, compte-rendu actualisé et à peine modifié d’une conférence que nous avons présentée il y a quelques années, dans une formation en médecine interne vétérinaire. Nous espérons que ce texte apportera des réponses aux multiples questions et idées reçues suscitées par la leishmaniose. Il se veut exhaustif, il est donc assez long ; les lecteurs qui souhaitent une information plus synthétique pourront se concentrer sur la répartition de la maladie au niveau local, les symptômes, le traitement, et surtout la prévention (répulsifs et vaccin).
Le parasite
Allez, un peu de classification pour commencer : les leishmanies sont des protozoaires (= organisme animal constitué d’une seule cellule, selon la définition de l’Académie de médecine), flagellés (= dotés d’un flagelle ; ça, ça va). Elles appartiennent à la famille des Trypanosomatidés, comme (entre autres), l’agent de la maladie du sommeil chez l’humain. (Cela dit juste pour illustrer la classification, après, rien à voir entre les deux maladies). Les leishmanies existent sous deux formes : les amastigotes = forme ovoïde immobile, dotée d’un noyau (arrondi) et d’un kinétoplaste (en bâtonnet), qu’on trouve à l’intérieur des cellules des vertébrés contaminés, notamment l’humain et le chien ; et les promastigotes = forme allongée mobile un peu plus grande, et dotée d’un flagelle en plus du noyau et du kinétoplaste, que l’on trouve chez le vecteur (= phlébotome, on en parle juste après) : les promastigotes constituent la forme infestante.
Il existe un très grand nombre d’espèces de leishmanies à travers le monde (L. tropica, L. major, L. infantum, L. donovani…), et un grand polymorphisme à l’intérieur de ces espèces : dans les années 2010, 712 souches de Leishmania infantum étaient décrites, uniquement dans le sud de la France ! Il y en a peut-être davantage aujourd’hui.
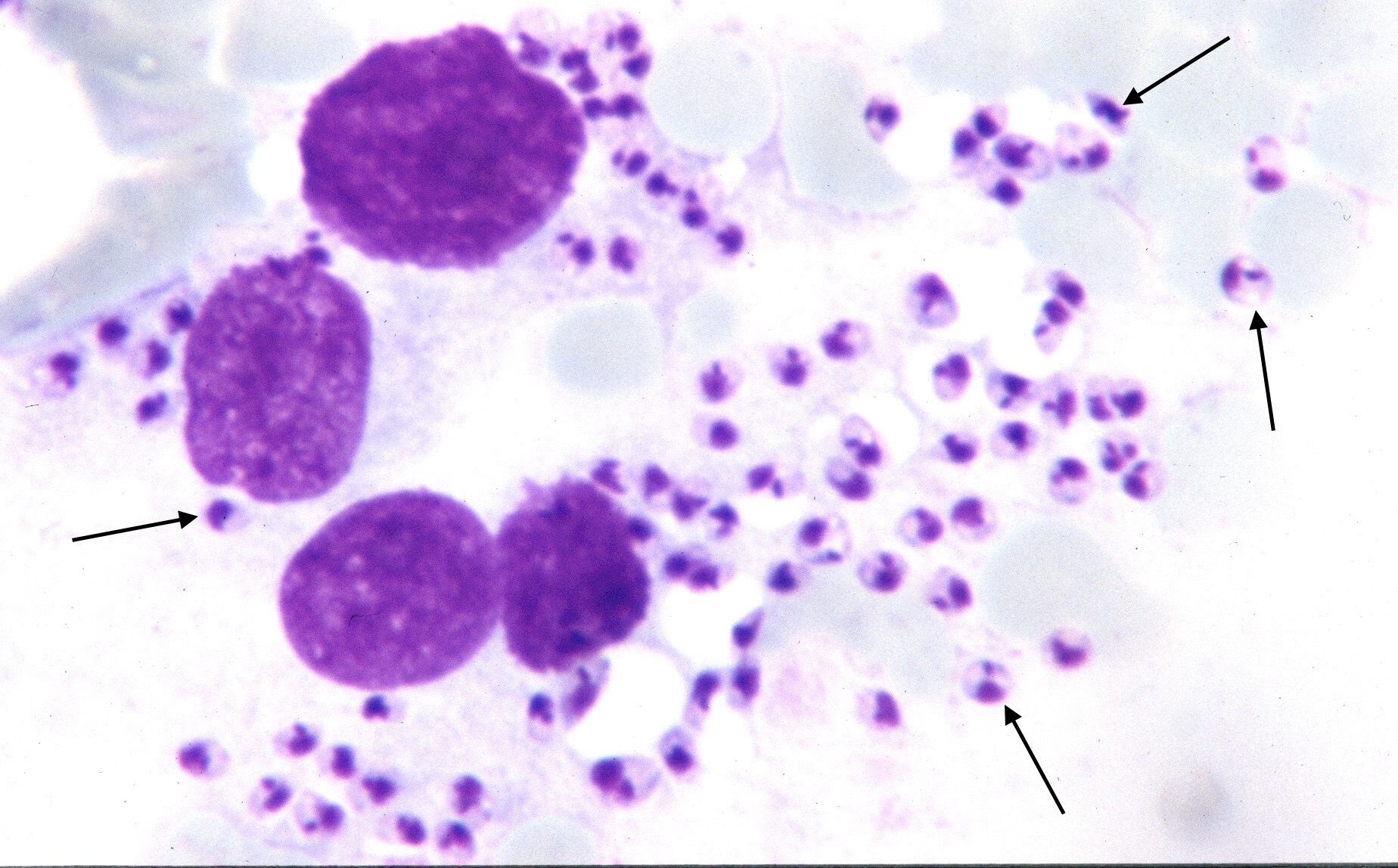
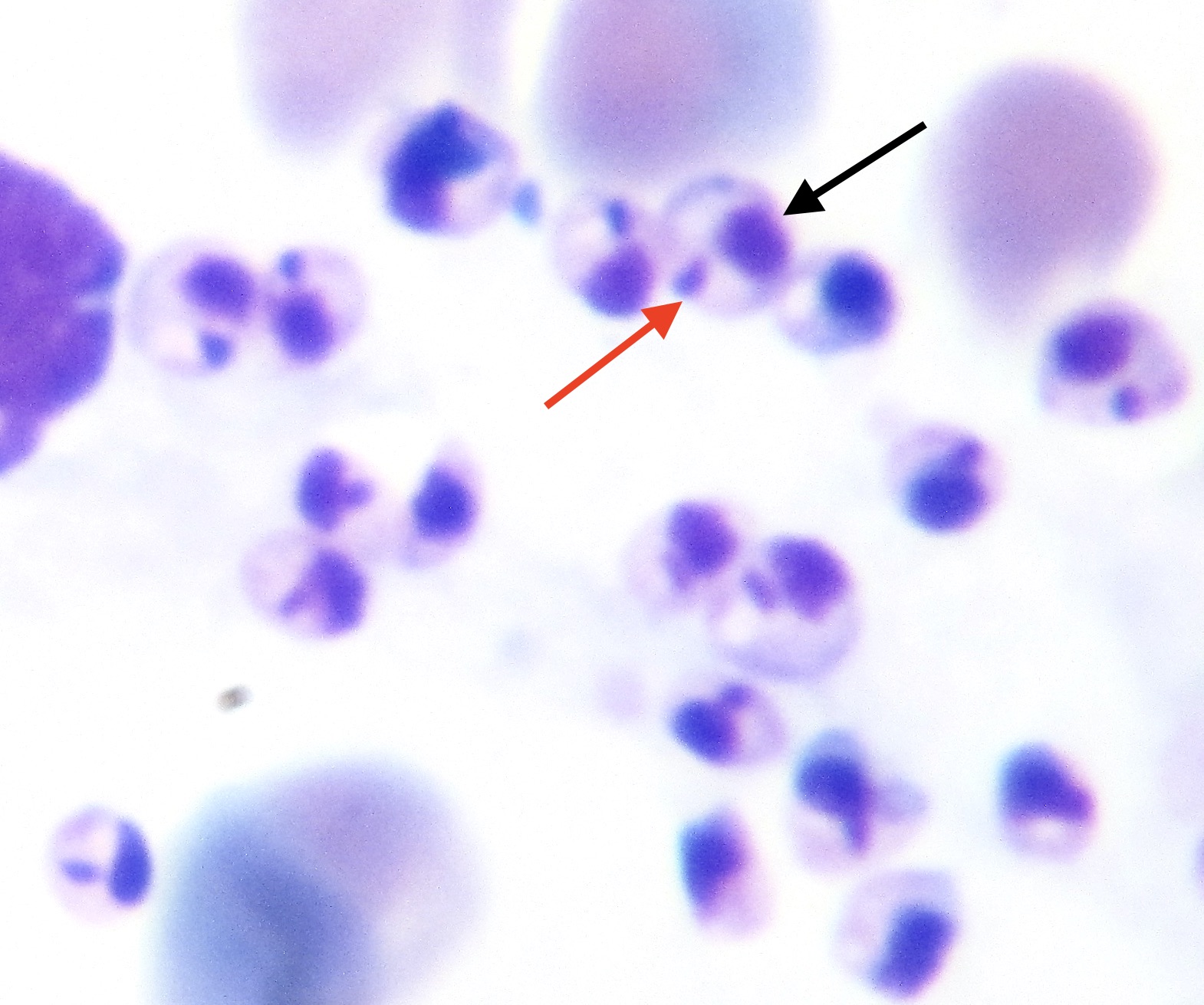
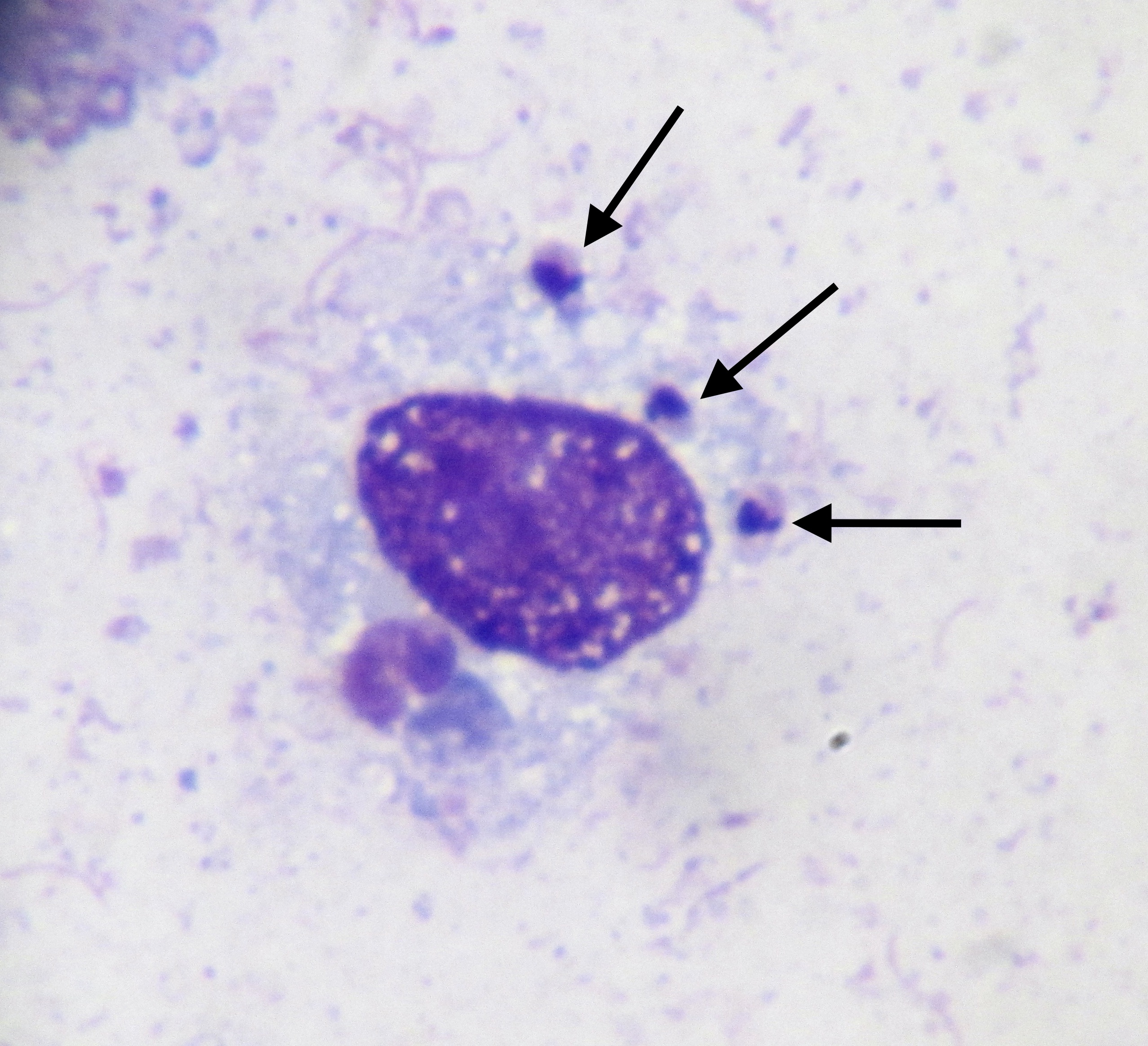
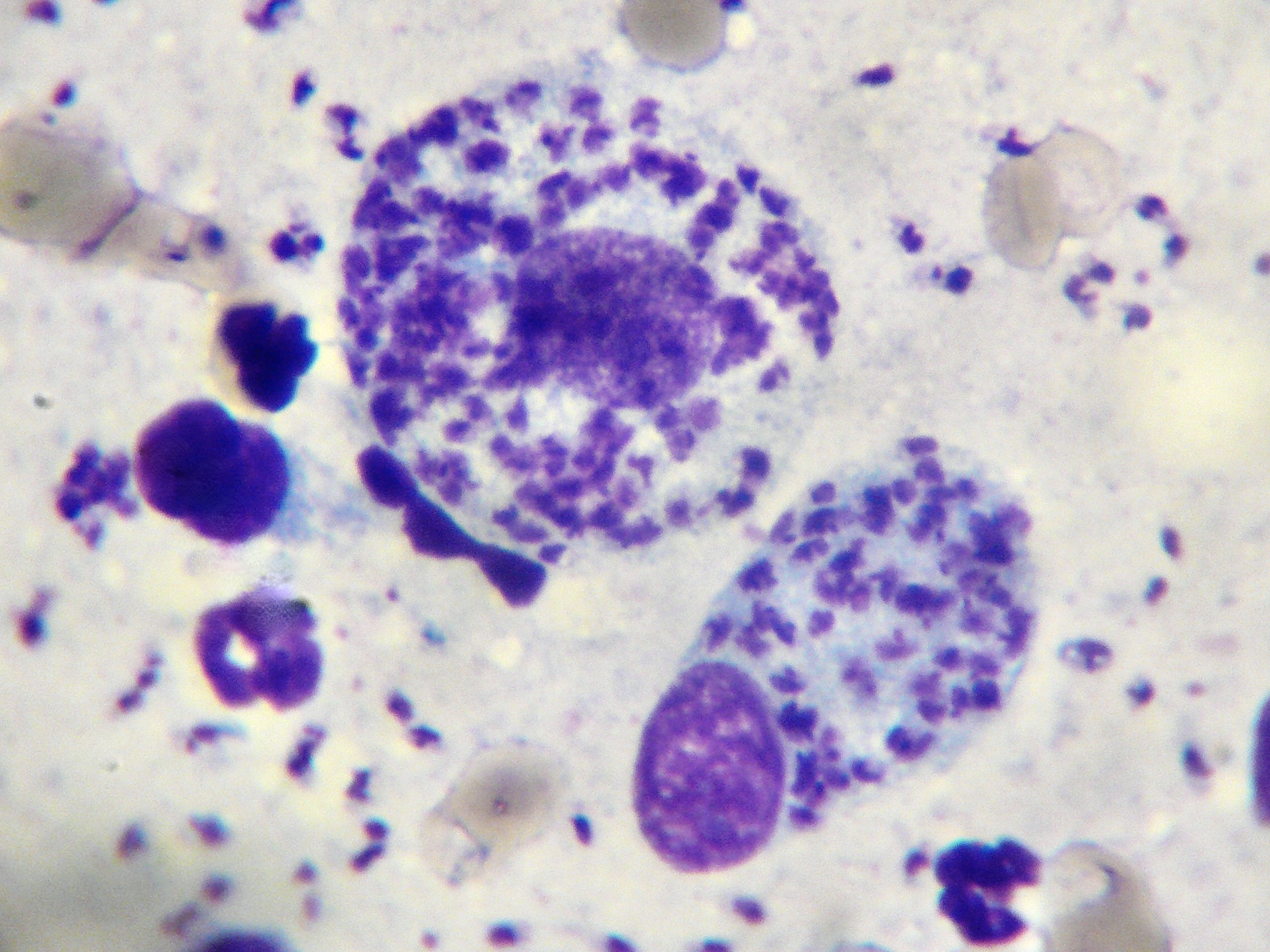
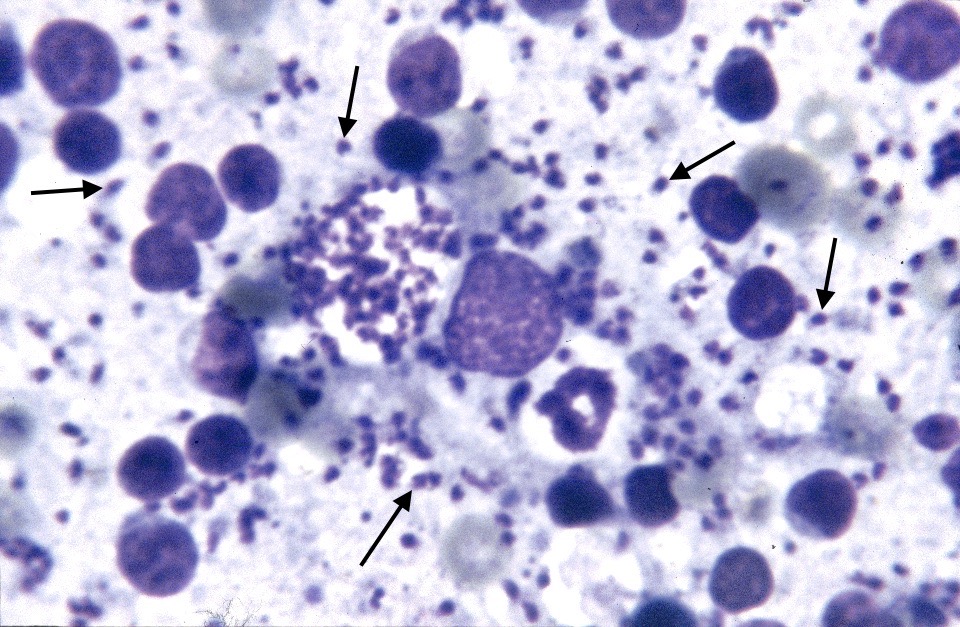
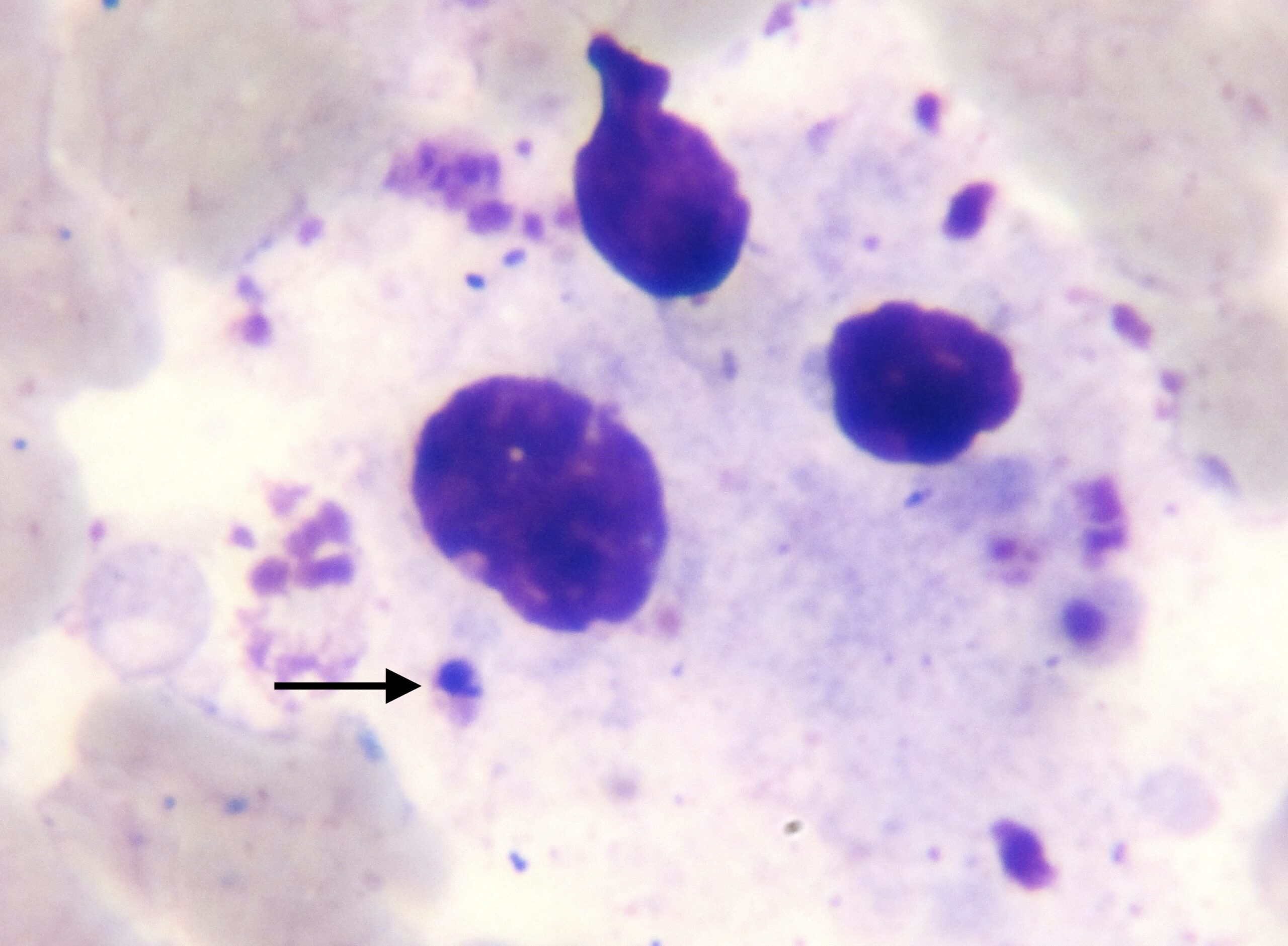
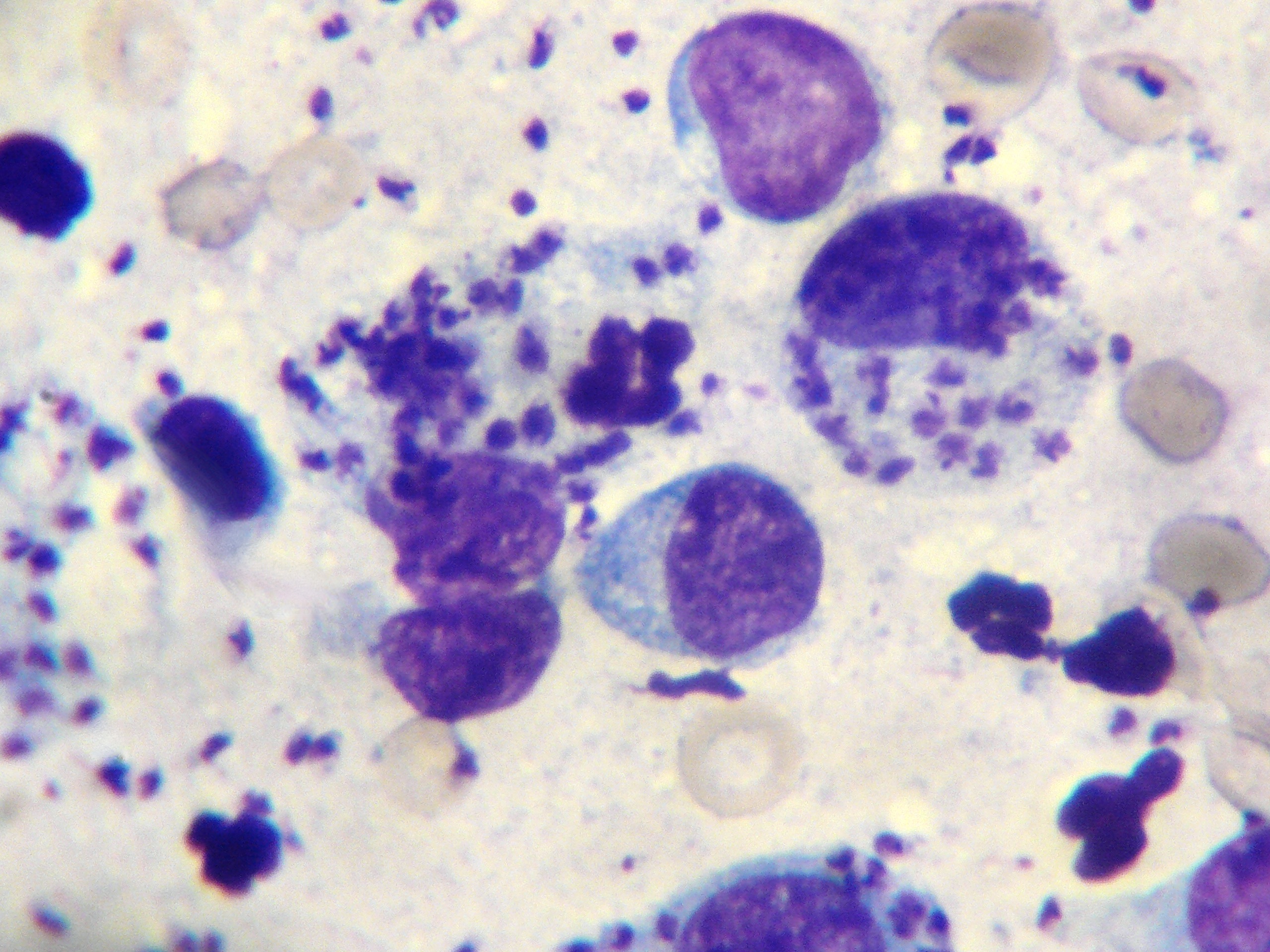
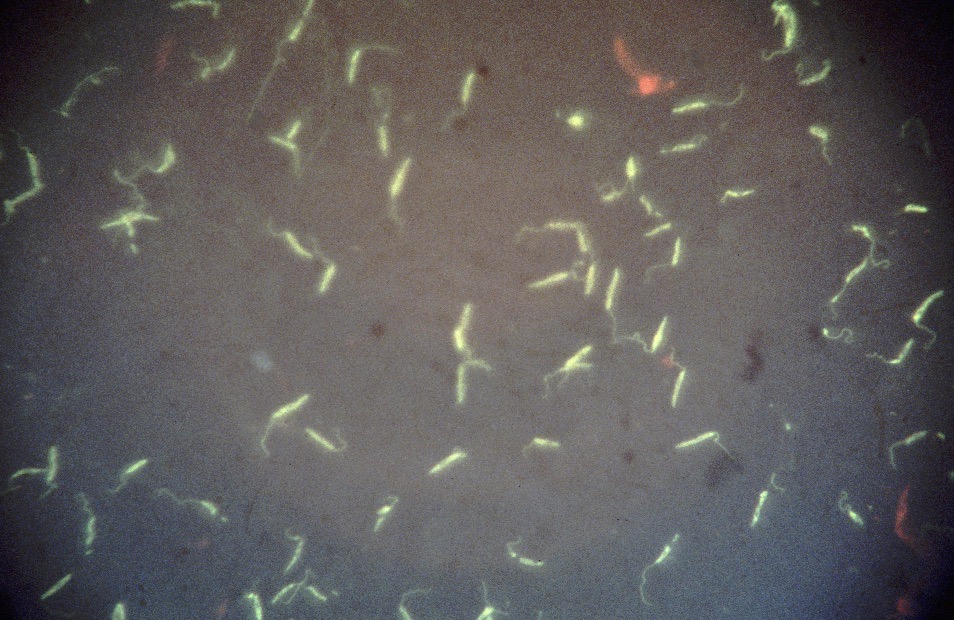
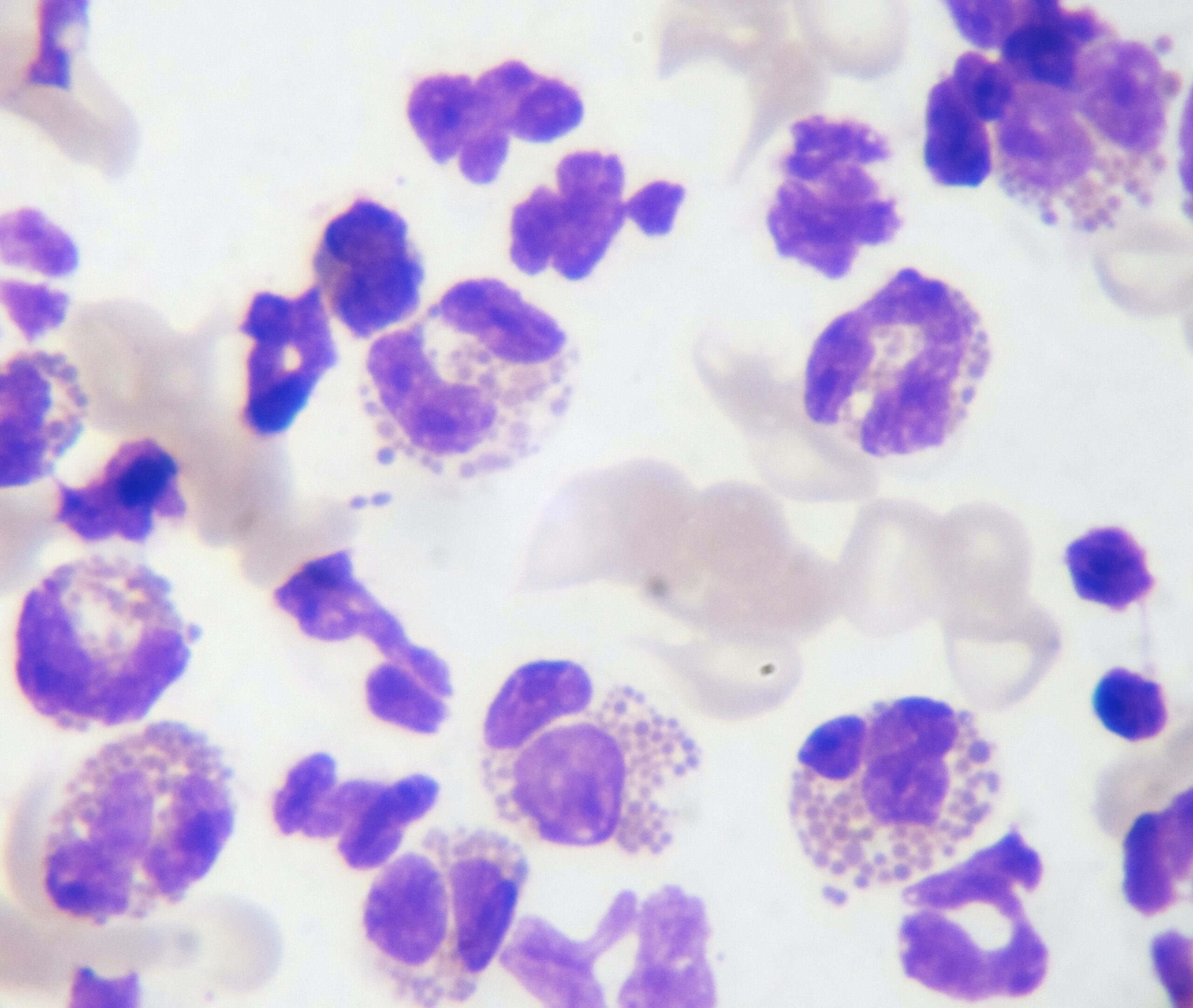
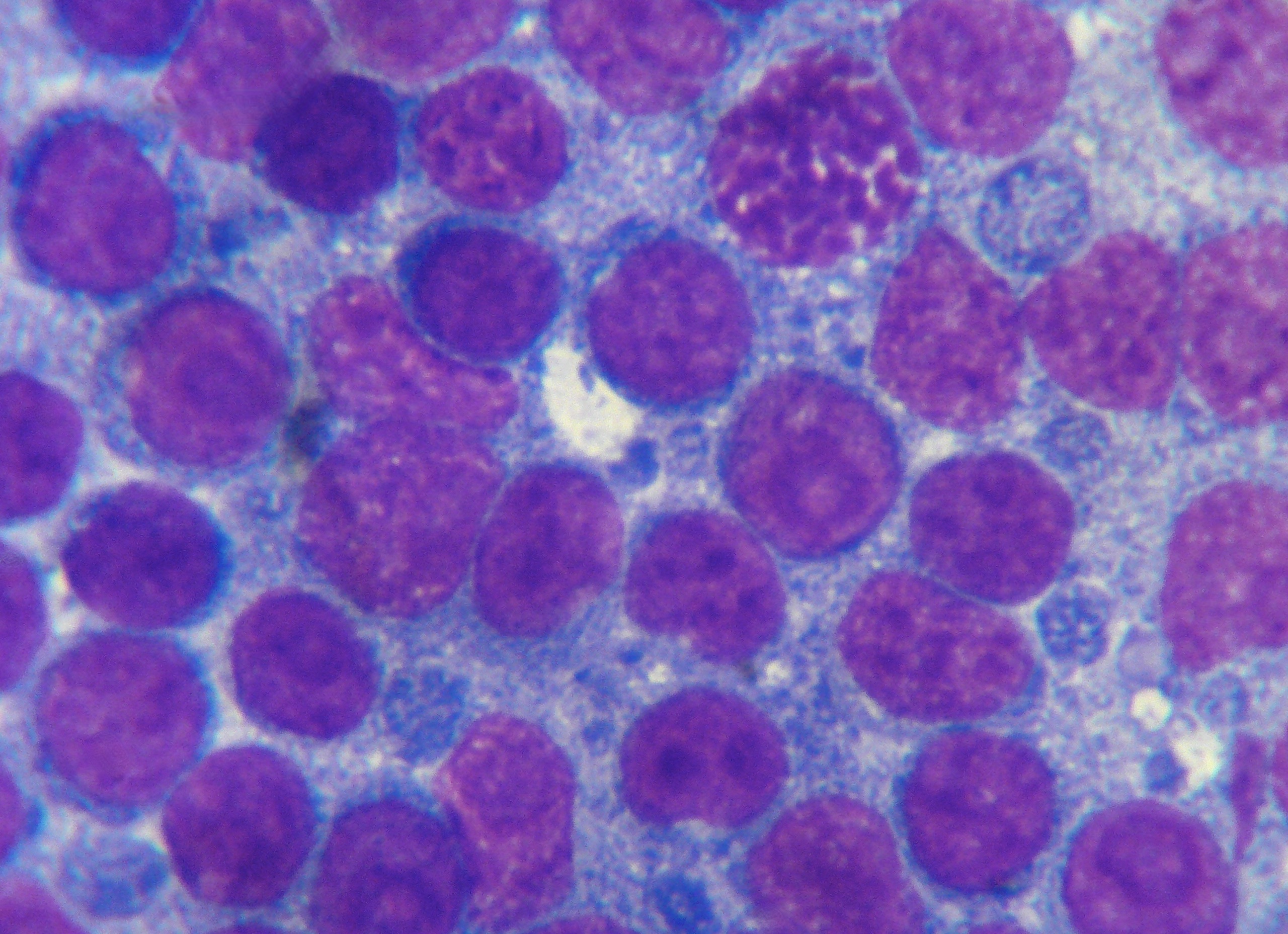
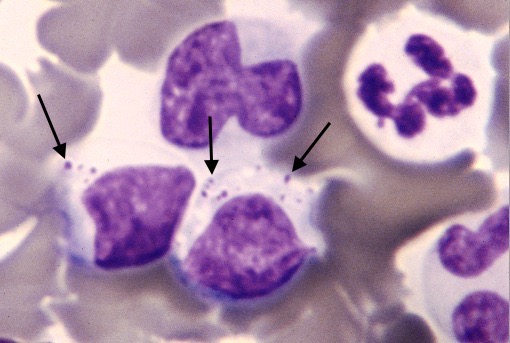
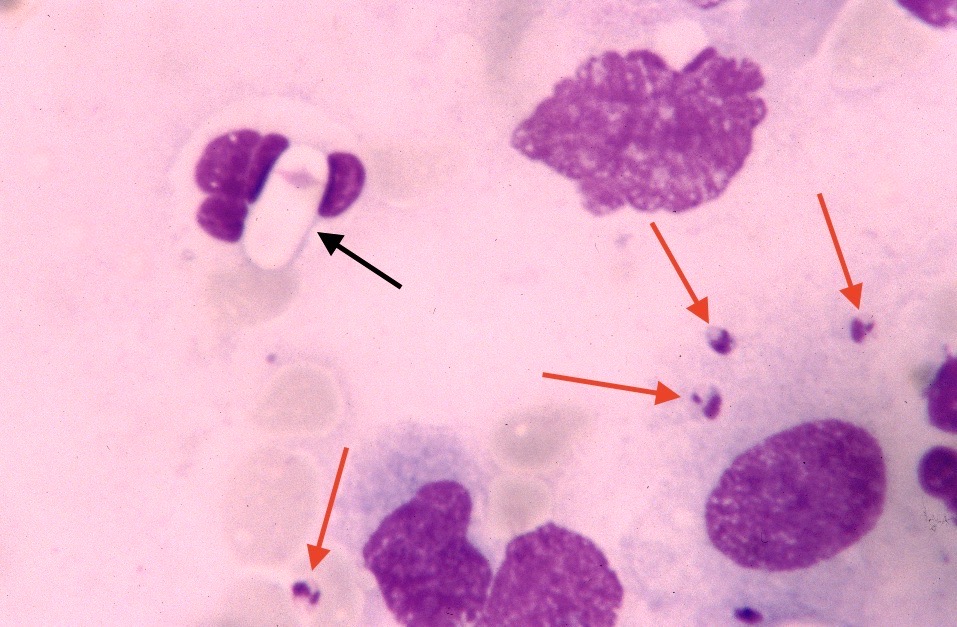
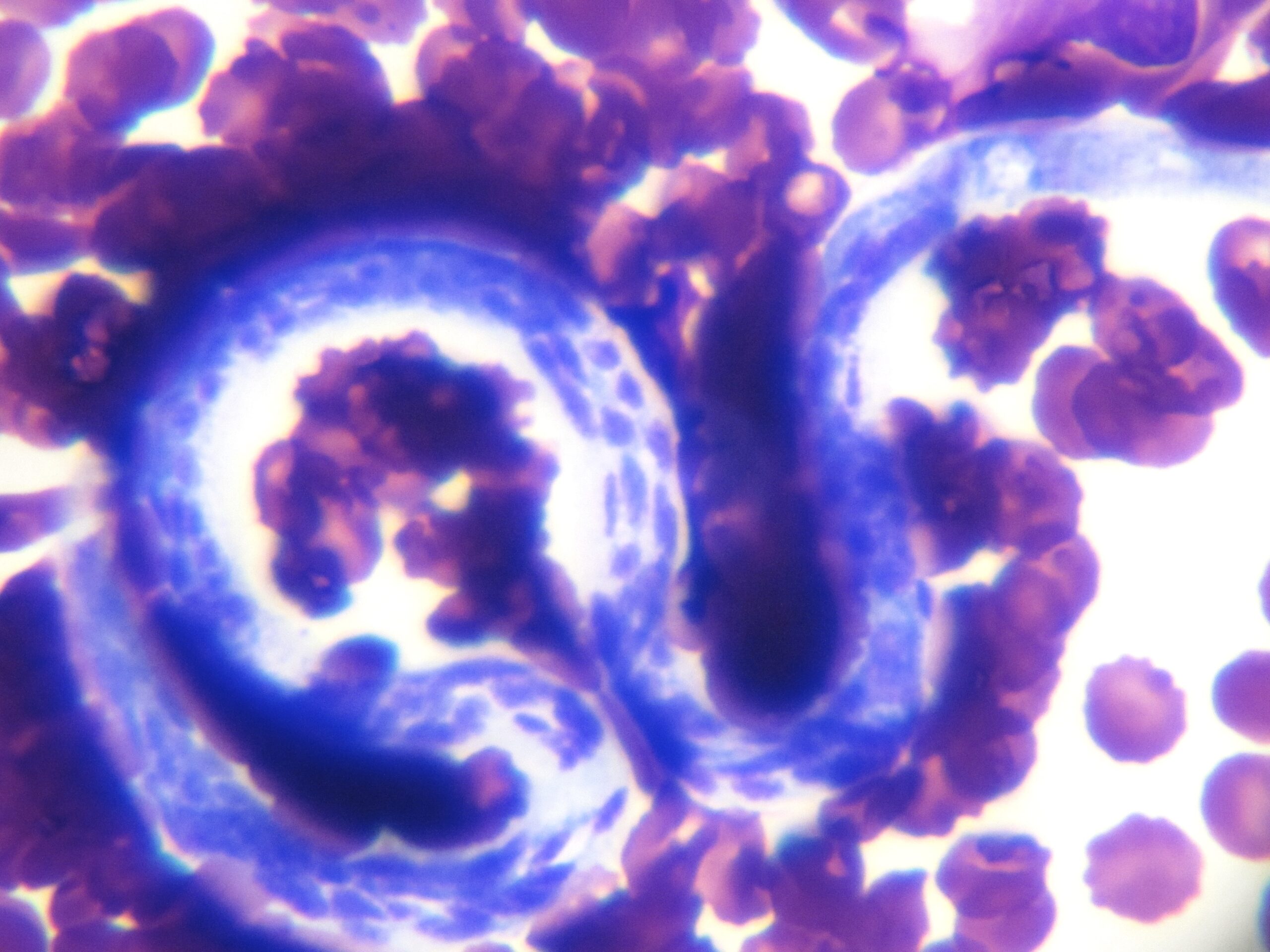
Photo ci-dessus : très nombreuses leishmanies (flèches) à l’intérieur des macrophages d’un étalement de moelle osseuse, chez un chien. Photo ci-contre : gros plan sur les minuscules bestioles (3 à 5 µm, soit 3 à 5 millièmes de millimètre, ce qui ne fait pas beaucoup) : une forme en navette, contenant deux inclusions : un noyau (flèche noire), et un kinétoplaste (flèche rouge).
Les leishmanies vivent à l’intérieur de certaines cellules (macrophages) de leur hôte (chiens et humains, pour ce qui nous intéresse ici), où elles survivent en développant différents mécanismes de protection, et où elles se multiplient. Lors du repas sanguin du phlébotome, les leishmanies sont aspirées, et se retrouvent dans l’intestin de l’insecte. Si par malheur (pour la leishmanie), l’insecte n’est pas un phlébotome, les parasites seront impitoyablement éliminés. S’il s’agit bien d’un phlébotome, en 4 à 20 jours selon la température, (optimum à 25°C, cycle impossible à 0 ou 30°C), les leishmanies vont se multiplier, se transformer, et migrer de l’intestin du phlébotome vers ses glandes salivaires. Chez l’un des deux phlébotomes présents dans la région (P. ariasi), cette évolution est particulièrement lente (19-21 jours), car les leishmanies infectieuses n’apparaissent dans la trompe de l’insecte piqueur qu’après deux repas sanguins suivant le repas contaminateur. Quoi qu’il en soit, une fois dans les glandes salivaires, les leishmanies sont maintenant prêtes à être réinjectées dans la peau d’un mammifère, lors du prochain repas sanguin de l’insecte.
Ce qu’il faut retenir de ces détails un peu techniques, c’est que seul le phlébotome peut transmettre la leishmaniose (pas une tique, ni un moustique « ordinaire »), qu’une maturation est nécessaire dans le corps du phlébotome qui ne pourra donc pas transmettre la maladie en piquant deux chiens à la suite, et qu’une température assez élevée (mais pas trop) est nécessaire.
Epidémiologie
1 – Répartition géographique :
On rencontre principalement la leishmaniose autour de la Méditerranée et au Moyen-Orient, en Afrique du Nord et de l’Est, en Asie (Inde, Bengladesh et Chine), aux USA, en Amérique centrale et en Amérique du sud (y compris notamment la Guyane française). En France métropolitaine, la maladie est essentiellement présente dans cinq foyers, tous dans le sud du pays : Pyrénées-Orientales, Cévennes (pour ce qui nous concerne), Provence, Côte d’Azur et Corse. Dans une enquête de 2011, au moins une clinique vétérinaire déclarait plus de cinquante cas par an, dans onze départements (cartes ci-dessous). Les chiens voyageant beaucoup (avec leurs maîtres), et le réchauffement climatique favorisant le déplacement des phlébotomes vers de nouvelles régions aux températures plus douces, la maladie sort depuis quelques années de ses cinq foyers traditionnels du sud pour s’étendre vers le sud-ouest et la région lyonnaise, avec quelques foyers plus au nord : Allier, Puy de Dôme, Touraine… La zone d’endémie (c’est à dire les endroits où la maladie est installée de façon pérenne) a ainsi progressé de 9% entre 2011 et 2017, passant de 26 à 29 départements. (Cartes 2017 ci-dessous. Source : MSD santé animale).
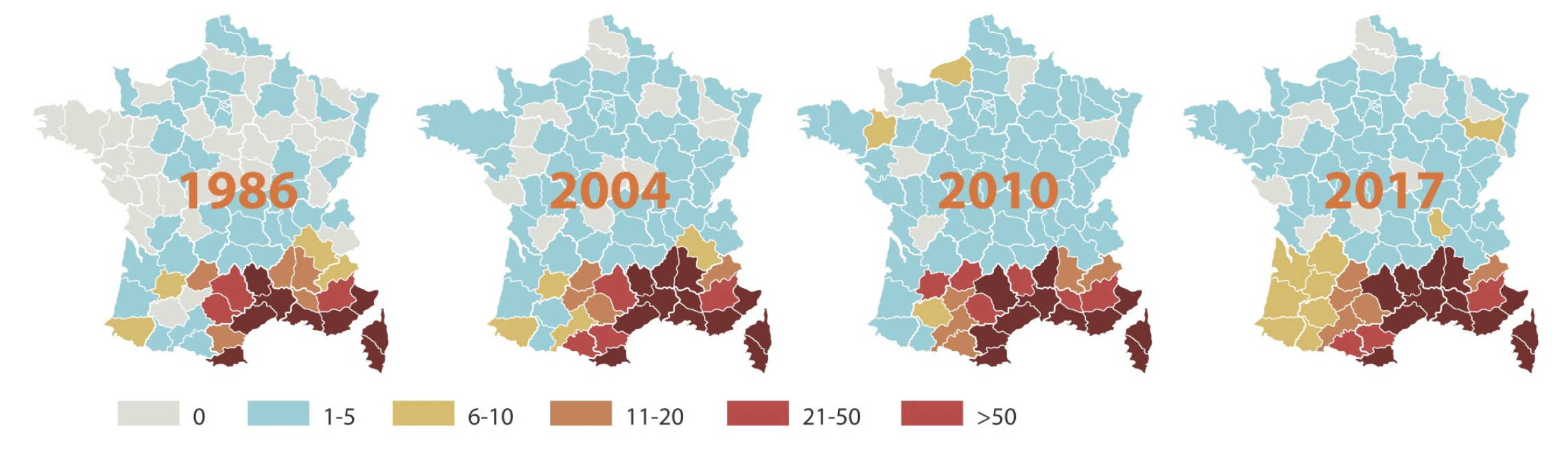
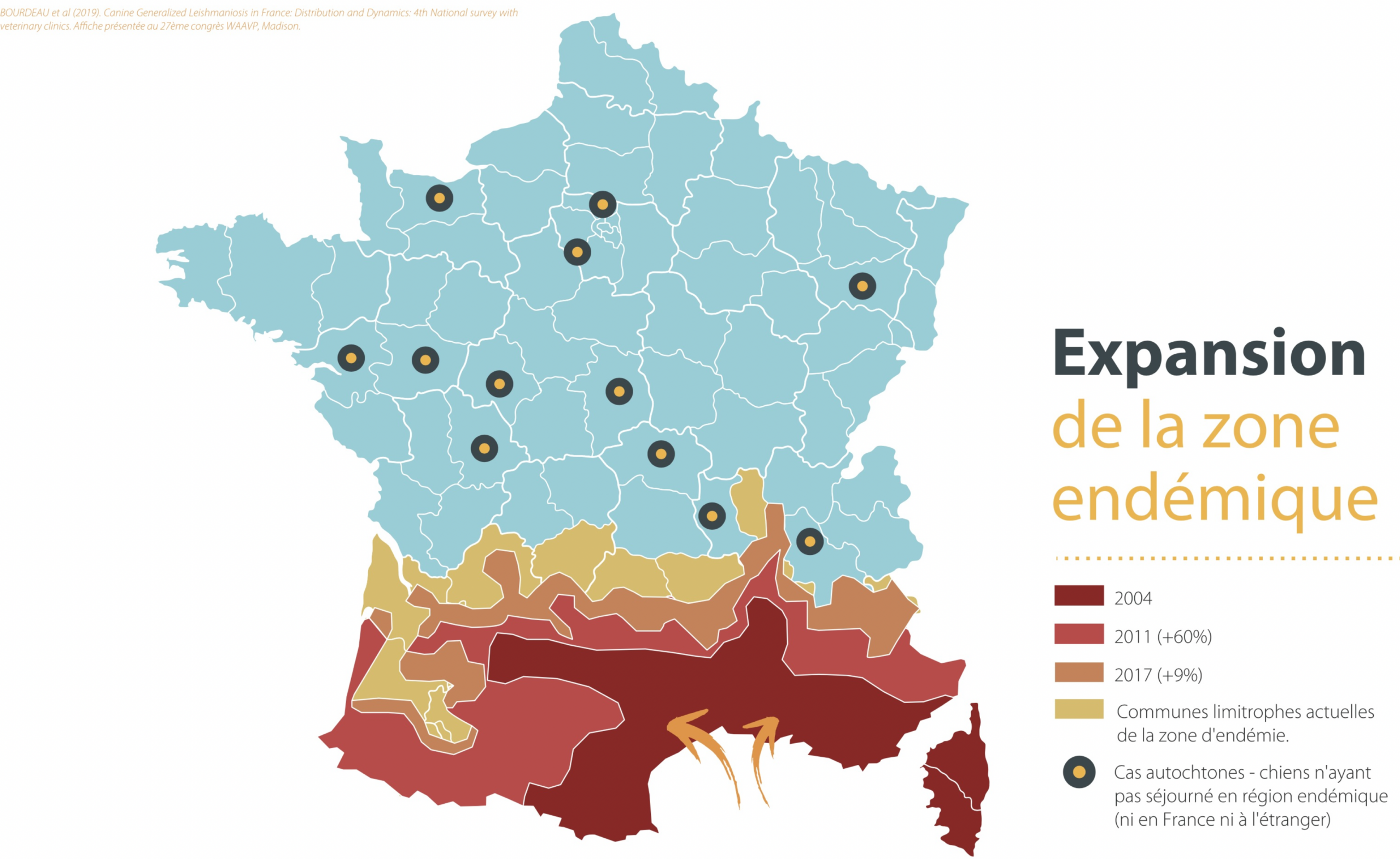
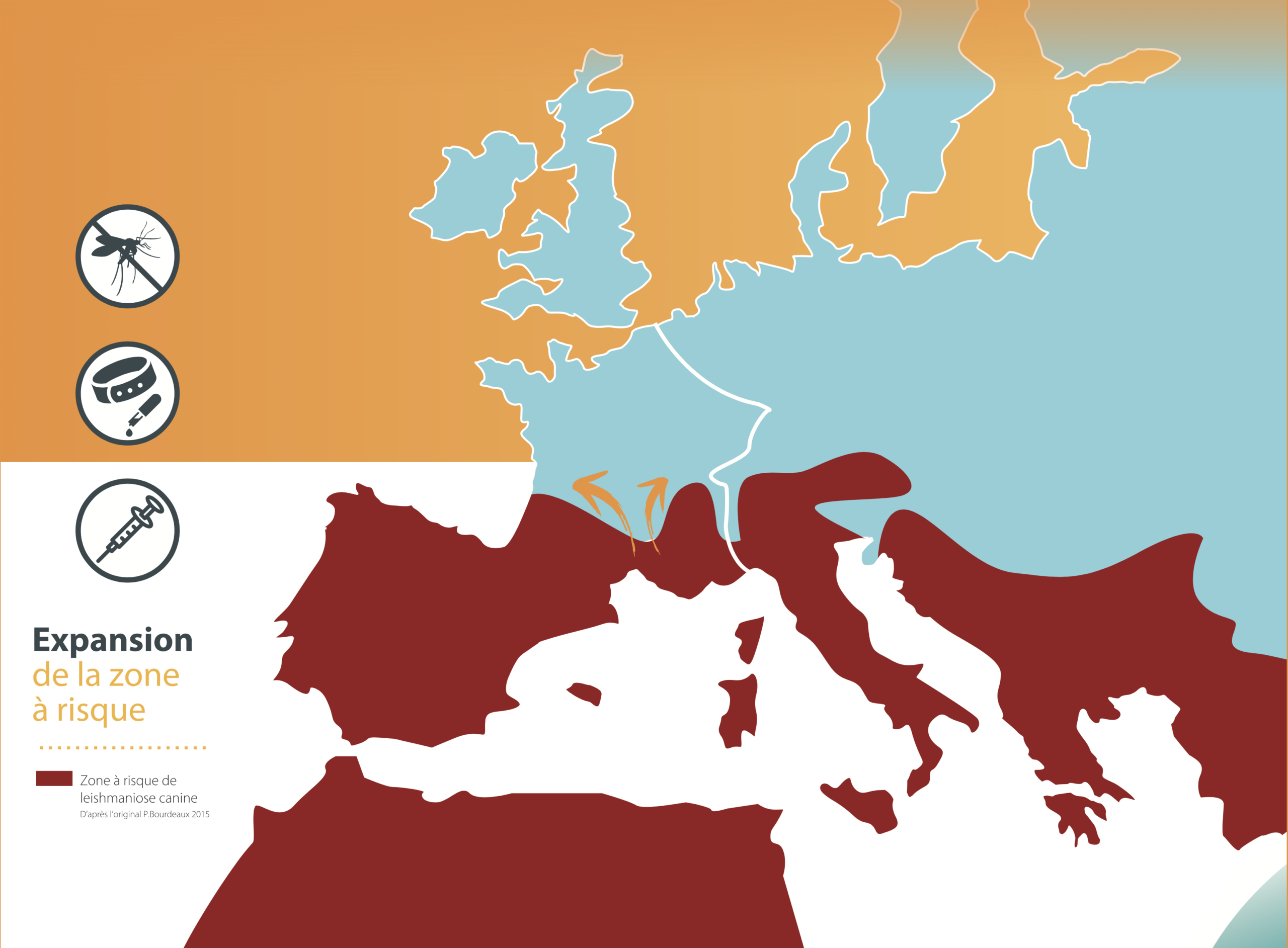
Cartes ci-dessus : en haut, la répartition des cas de leishmaniose en France par département, et l’expansion de la zone d’endémie entre 1986 et 2017. Petite explication concernant le code couleur des cartes du haut (11-20, 21-50, > 50) : il ne correspond pas au nombre de cas annuels dans tel ou tel département : 50 cas par an pour tout un département en zone d’endémie, ça ne ferait vraiment pas beaucoup ! Ce code indique le nombre maximal de cas annuels rapporté par les cliniques du département. Donc s’il y a dans un département vingt cliniques qui voient 10 cas de leishmaniose par an, et une qui en voit 25, le code couleur correspondra à la fourchette 21-50. En bas, les zones d’endémie de leishmaniose en Europe et en Afrique du nord. (Origine des cartes : P. Bourdeau & Coll 2019, documents MSD Santé animale).
Au niveau très local, mais alors là, ça ne va vraiment intéresser que les personnes habitant (ou venant en vacances) à proximité de nos deux cliniques : on trouve de la leishmaniose à Sommières (notamment sur les collines environnantes : Villevieille, « montée EDF »… mais aussi dans la vallée, le long du Vidourle), dans les villages à proximité immédiate (Aubais, Junas, Saussines…), et dans la plupart des localités en direction de l’ouest vers le pic Saint-Loup (Saint-Bauzille de Montmel, Sainte Croix de Quintillargues, Saint Mathieu de Tréviers…)(photo ci-dessous), et du nord vers les Cévennes : Salinelles, Souvignargues, Fontanes, Combas, St Mamert, Fons… et bien sûr, au-delà vers Quissac, et dans toutes les Cévennes. En revanche, toujours à partir de Sommières, on en trouve peu lorsque l’on prend la direction de Montpellier, (Boisseron…), ou de la mer (Lunel…). D’ailleurs, quand on s’approche de la mer, on n’en trouve plus du tout : le phlébotome veut ses petites collines et ses chênes verts ! On trouve également peu de cas dans la Vaunage (Calvisson, Langlade, Caveirac, Clarensac…), même si nous en avons rencontré occasionnellement dans chacune de ces localités.

Entre Sommières et Saint-Mathieu de Tréviers, un petit paradis pour phlébotomes (et leishmanies).
Petite précision qui n’a sans doute pas de grande valeur épidémiologique au niveau national, mais tout de même : tandis que la leishmaniose s’étend à de nouveaux foyers, au niveau très local, le nombre de cas que nous rencontrons a très fortement diminué depuis les années 1990 – début des années 2000. A cette époque, nous diagnostiquions plus de 50 nouveaux cas de leishmaniose par an, soit un nouveau cas par semaine ; ajoutez à cela les visites de suivi, ça faisait beaucoup de chiens leishmaniens en consultation ! En 2023, alors que nous voyons beaucoup plus de patients qu’il y a 20 ou 30 ans, nous avons diagnostiqué… 6 nouveaux cas. Cette diminution va dans le même sens que la baisse globale du nombre de cas de de maladies parasitaires (ehrlichiose, hépatozoonose, mycoplasmose chez le chat, parasites digestifs…), que nous avons constatée ces vingt dernières années ; nous attribuons ce phénomène à deux évolutions tout à fait positive depuis les années 1980-1990 : d’abord une très nette amélioration du mode de vie des animaux en général, et des chiens en particulier : la plupart des chiens de meute qui vivaient dans un chenil au fond du jardin (donc très exposés aux tiques, moustiques, phlébotomes…), se sont en effet transformés en épagneuls dormant sur le canapé – pour ne parler que des chiens de chasse, les plus exposés. D’autre part, vermifuges, anti-parasitaires externes, répulsifs anti-phlébotomes… et maintenant vaccin (à lire vers la fin de cet article), se sont généralisés. Eh oui, comme chez nous, quand l’hygiène progresse, les maladies reculent. Donc extension de la zone géographique de la leishmaniose, certes, mais très forte diminution du nombre de cas au niveau local.
2 – Le réservoir : le chien
Le réservoir de parasites est essentiellement constitué par les canidés (chiens, mais aussi renards de façon plus anecdotique). 1,5 à 2% de chiens infectants suffisent à entretenir l’endémie… sachant que dans le foyer cévenol (c’est chez nous !), sur 253 chiens testés en 2002, dans le cadre d’une étude du Centre National de Référence sur les Leishmanioses, (Faculté de Médecine, Montpellier), 29,6% étaient positifs en sérologie, et… 79,8% positifs par PCR (= recherche moléculaire de la présence des leishmanies).
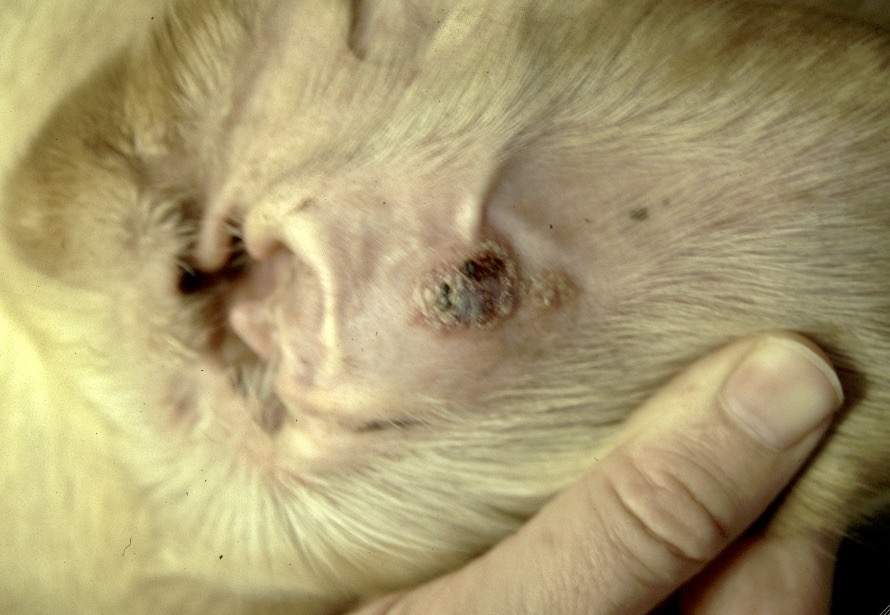
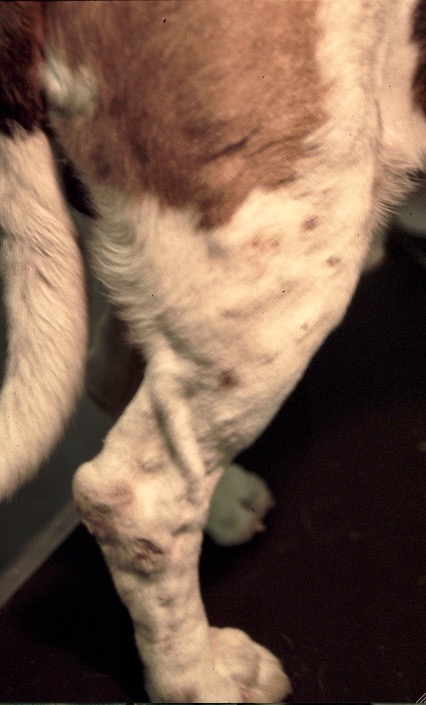
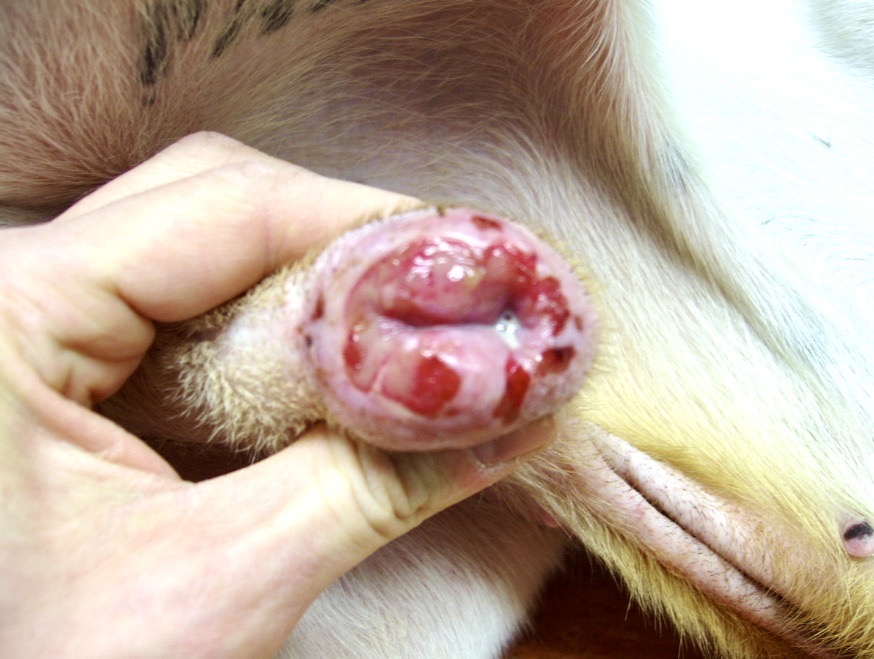
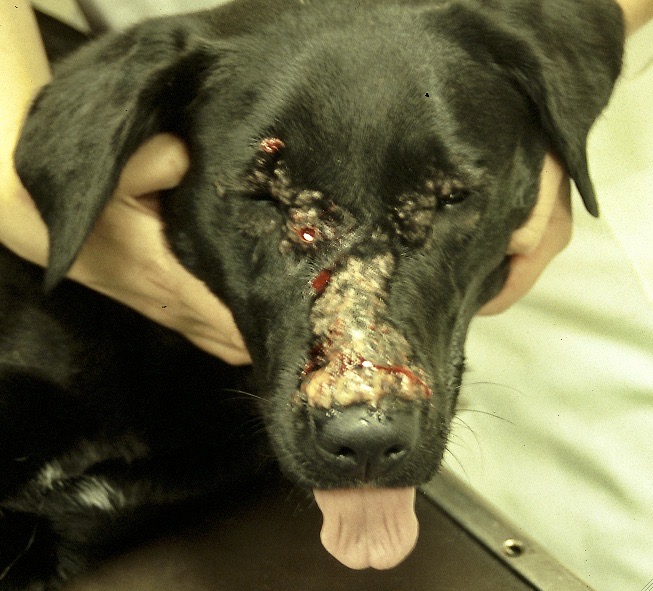
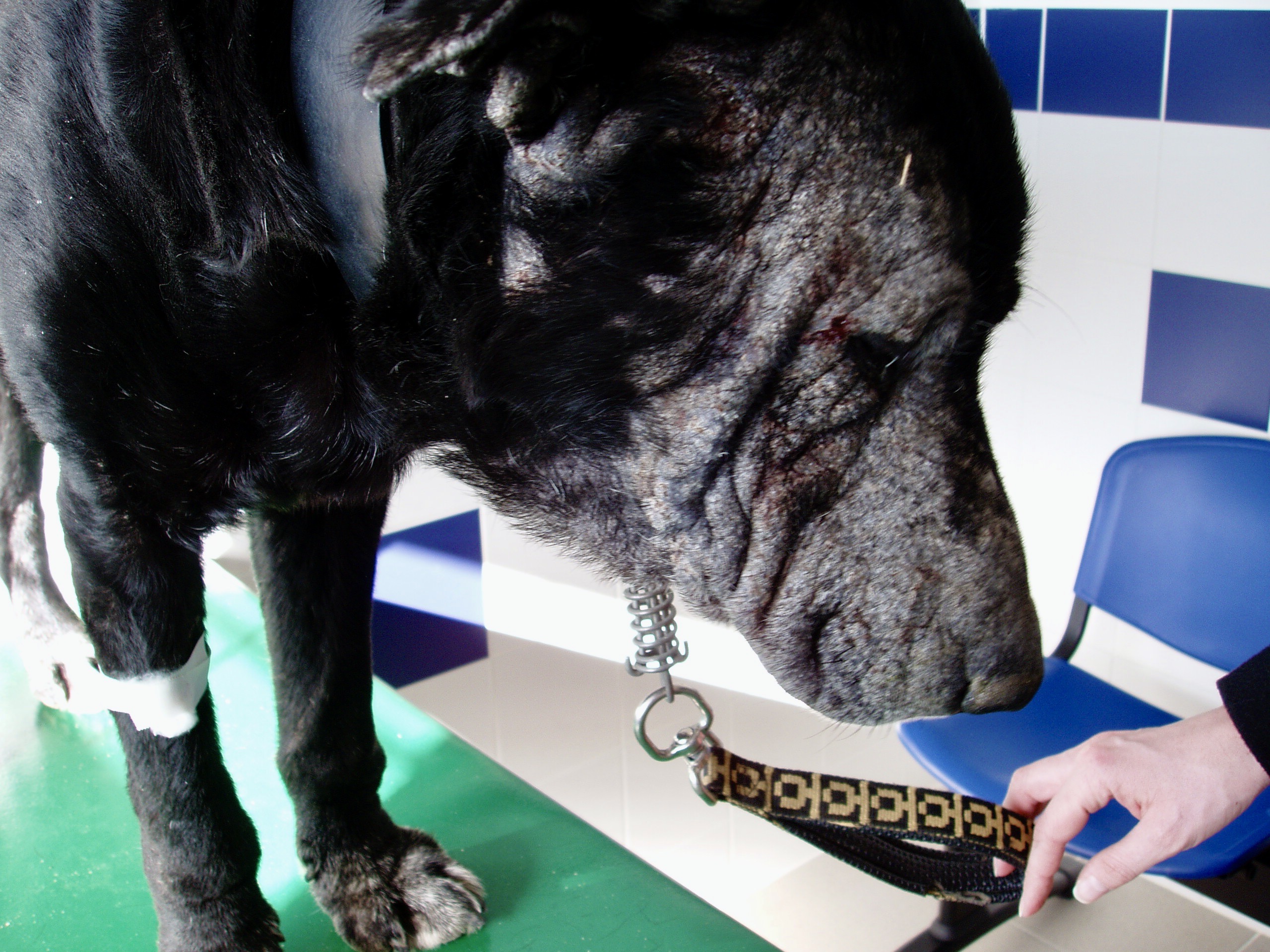
Les chiens malades, surtout s’ils présentent des lésions cutanées, sont classiquement considérés comme le principal réservoir (photo ci-dessous), mais plusieurs études ont montré que l’infectiosité n’était pas corrélée à la gravité des symptômes : dans l’étude de 2002, 89,4% des chiens présentant des symptômes, et 65,2% des chiens n’en présentant pas, avaient des leishmanies en circulation dans le sang, parfaitement disponibles donc pour se laisser avaler par la première phlébotome qui passe ! (la et pas le, parce qu’il n’y a que les femelles qui piquent, chez les phlébotomes). Donc, symptômes ou pas symptômes… ça nous fait quand même un sacré réservoir ! En revanche, les chiens leishmaniens traités par le GLUCANTIME, l’allopurinol ou leur association (voir vers la fin de cet article), sont moins (voire plus du tout) infectieux pour le phlébotome pendant les 4-5 mois qui suivent le début du traitement.
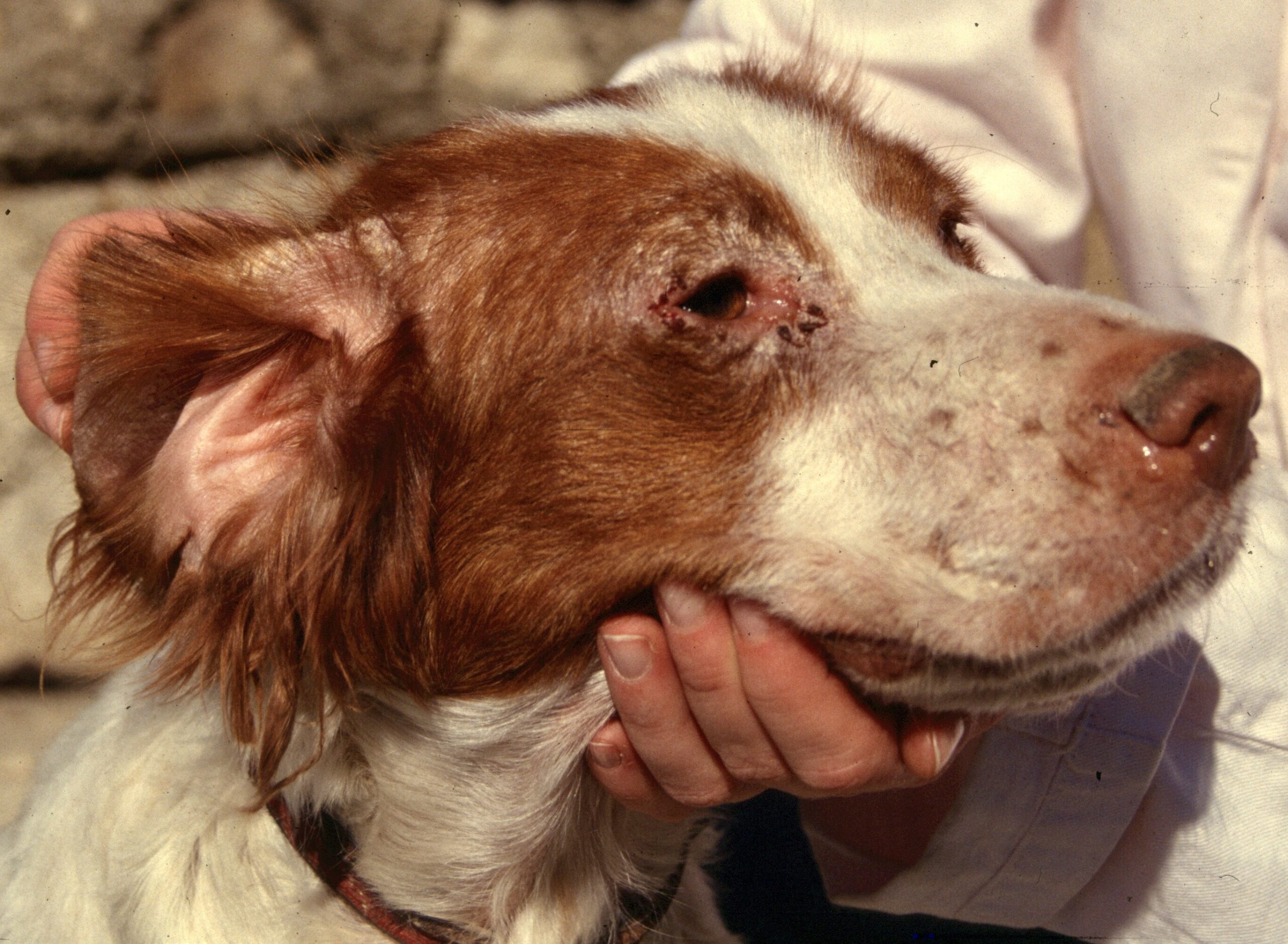
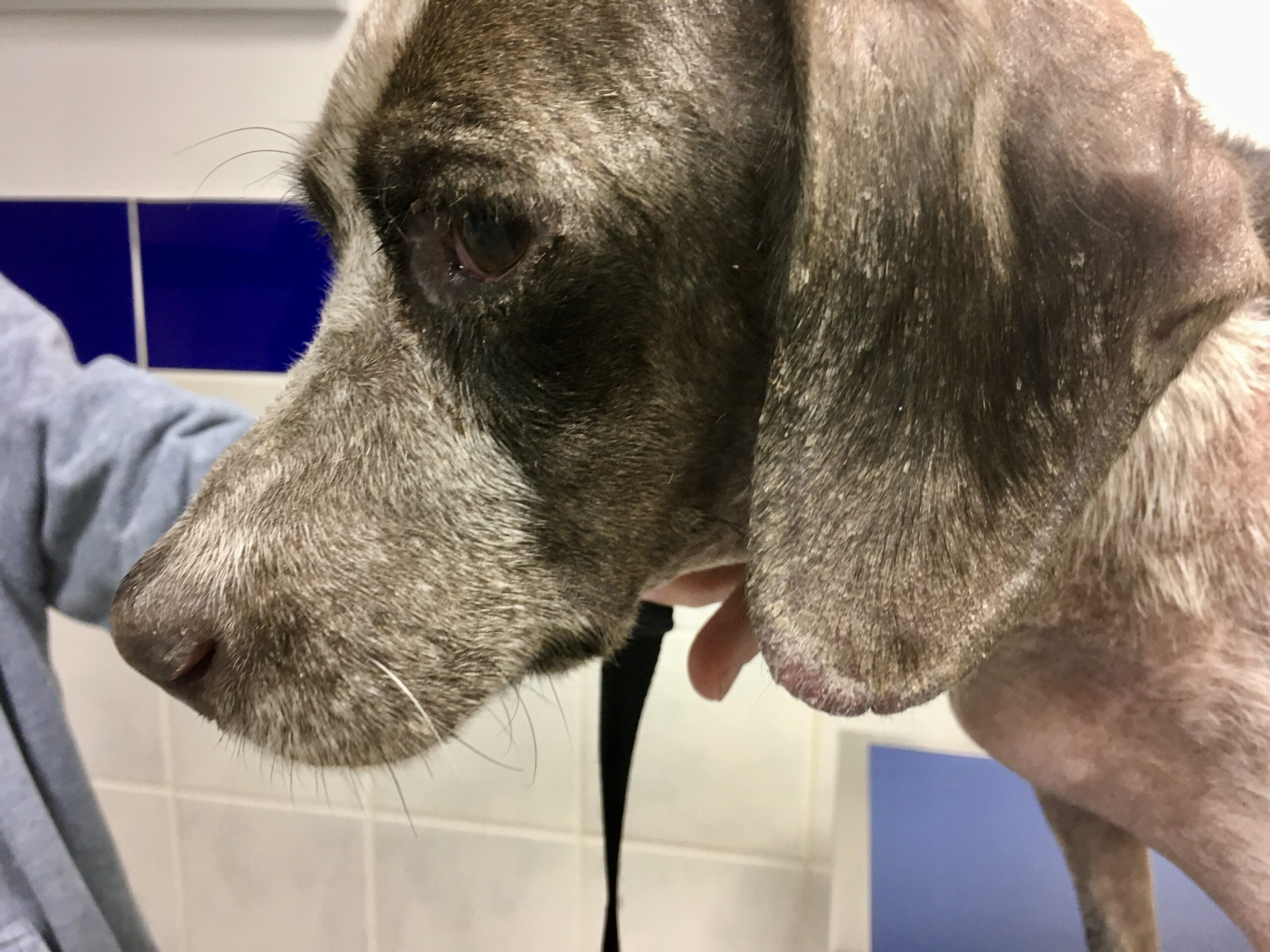
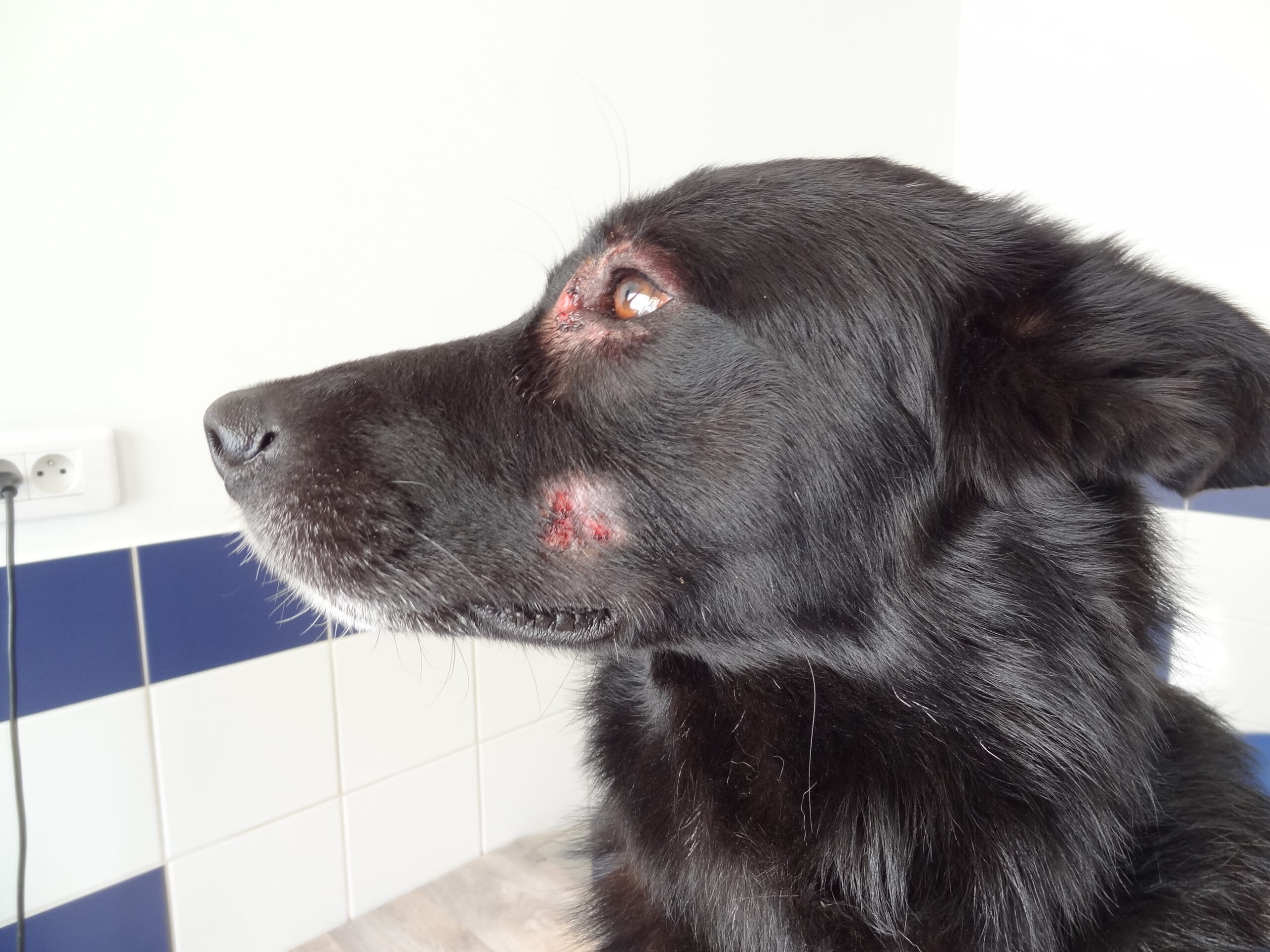
Toutes ces ulcérations sur la face de cet épagneul breton : un véritable festin pour les petites phlébotomes !
De rares cas de leishmaniose (avec symptômes) ont été rapportés chez le chat : 46 cas cliniques publiés dans le monde entre 1989 et 2014 (on en reparlera plus loin). Oui, mais que les chats fassent peu de symptômes ne veut pas dire qu’ils ne sont pas infectés : des études épidémiologiques ont certes montré une séroprévalence et des taux d’anticorps plus faibles chez le chat que chez le chien dans une région donnée, mais avec quand même des séroprévalences et des PCR positives pouvant atteindre respectivement 68 et 61% en zone d’endémie ! On considère malgré tout que le chat ne joue pas un rôle de réservoir important comparé au chien, mais qu’il peut permettre ponctuellement l’infection de phlébotomes. Pour le reste, Leishmania infantuma été trouvée chez de nombreuses autres espèces animales, (rats, écureuils, chevaux, vaches, moutons…), mais le rôle de réservoir de ces espèces n’a pas été démontré.
3 – Le vecteur : le phlébotome
En France, la transmission est le fait de deux insectes : Phlebotomus ariasi, et Phlebotomus perniciosus. Ce ne sont pas des moustiques au sens strict, comme on l’entend souvent, mais de très petits « moucherons » (0,5 cm de long), silencieux, à activité crépusculaire ou nocturne (maximum d’activité entre 22 et 24 heures). Pendant la journée, ils trouvent refuge dans des endroits calmes et humides, comme les fissures dans les murs, les tas de bois ou de pierres, les déchets divers… Une densité minimale de 10-15 phlébotomes/m2 est nécessaire au maintien de l’endémie.
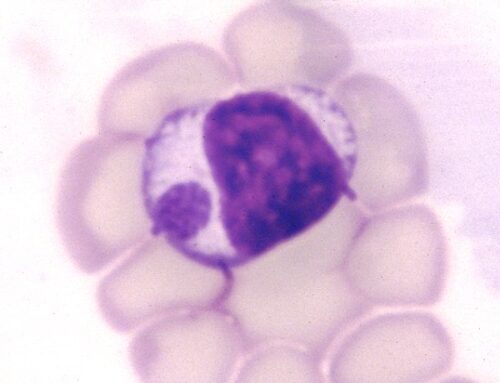
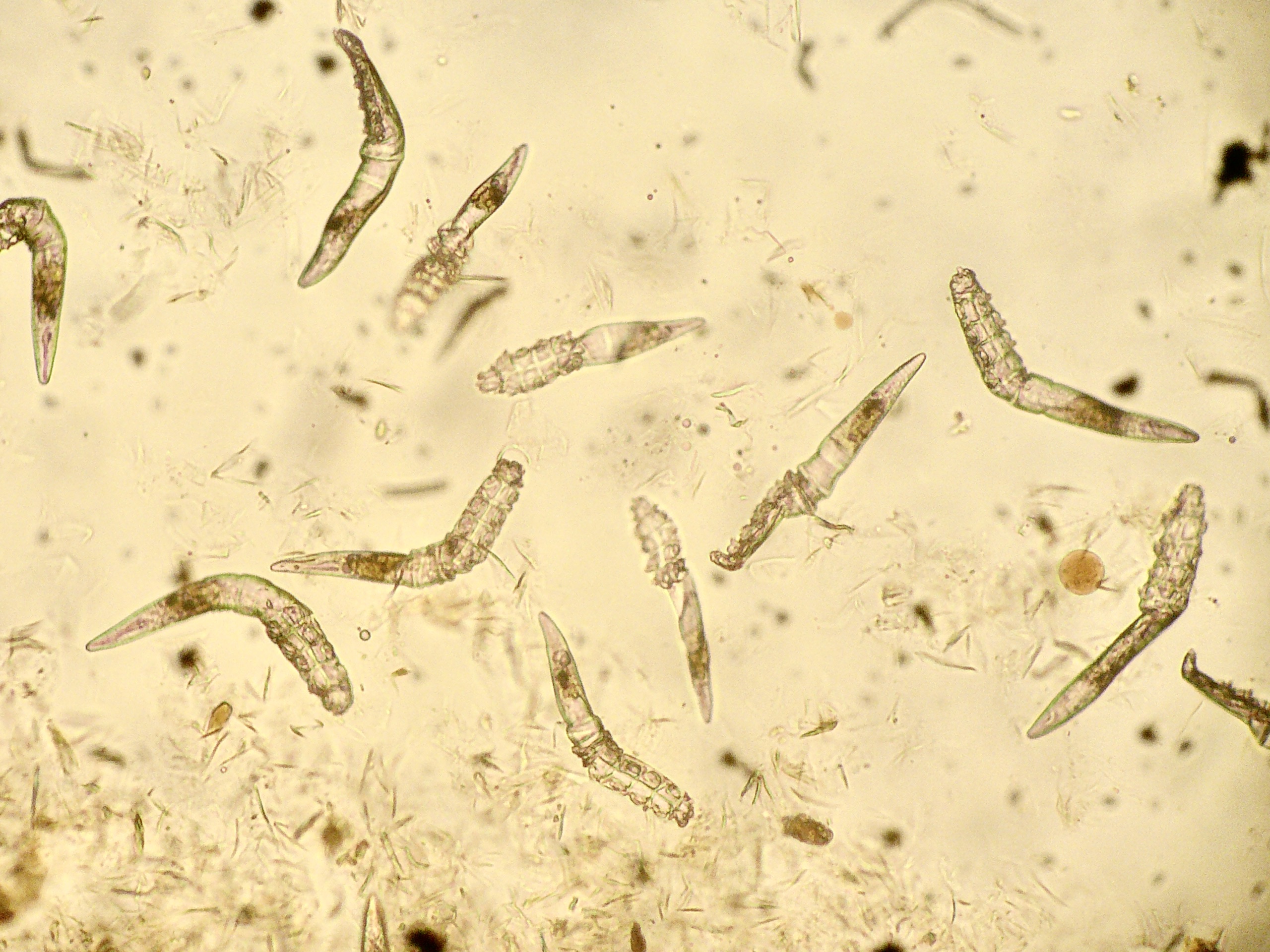
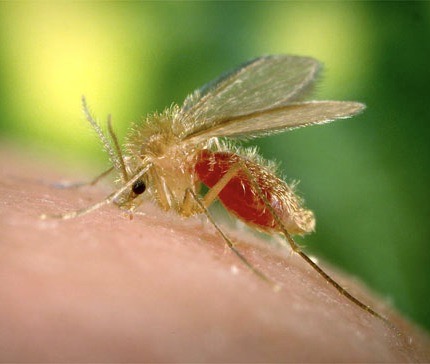
Seule la femelle se nourrit de sang, et exclusivement sur des mammifères. 0,5 à 3% d’entre elles sont porteuses de leishmanies, mais ce taux peut atteindre 20% dans une maison avec un chien leishmanien non traité. Une fois contaminé, un phlébotome conserve son pouvoir infectant pendant toute sa vie, à savoir 3 mois. (photo ci-contre : Phlebotomus papatasi, prenant son repas… sur la peau de l’auteur de la photo. Source : CDC/Frank Collins).
P. ariasi est prédominant dans les Cévennes (près de 90 % des captures) et dans les Pyrénées-Orientales. Il vit essentiellement à l’extérieur des habitations, sur les collines, à flanc de coteau (300-600 m) : c’est l’étage des chênaies mixtes à Quercus ilex, Q. suberet Q. pubescens, et c’est là qu’ont été observés les taux de prévalence canine et humaine les plus élevés. Les fonds de vallée (inversion thermique) et les cols ou sommets (trop venteux) sont relativement pauvres en P. ariasi, mais l’insecte peut néanmoins parcourir plus de deux km à partir de son foyer, avec passage de col et changement de versant. Son hôte électif est le chien, l’Homme à un degré moindre. Il s’agit d’une espèce exophile (autre raison pour laquelle il pique moins l’Homme), et il est repoussé par une lumière vive. Il peut néanmoins rentrer dans les maisons lorsque la température diminue, et il est attiré par une lumière faible (lampe de chevet derrière une fenêtre ouverte) : on en trouve jusqu’à 200/m2 dans une pièce faiblement éclairée. Sa densité est maximale du 15 juillet au 15 août, mais le repas sanguin, (donc la contamination), pris juste avant le dépôt d’œufs, est décalé vers l’automne, à partir de début septembre. L’automne constitue donc la grande période à risque, avec pour conséquence des poussées épidémiques pendant l’hiver et le printemps (quoique de nouveaux cas soient diagnostiqués toute l’année, du fait de la durée variable, et souvent longue, de l’incubation).

Collines de moyenne altitude, chênes verts, murailles de pierres sèches au cœur des Cévennes : tout ce qu’aime Phlebotomus ariasi.
P. perniciosus est plus important dans les foyers de Provence, Côte d’Azur et Corse, avec un pic printanier et un pic automnal (fréquence maximale entre fin août et mi-septembre). Il est présent en zônes rurale et sub-urbaine, dans l’arrière-pays plutôt que sur le rivage : ses biotopes sont le maquis et la garrigue, à végétation constituée de pinèdes, chênes kermès, genêts et cystes, ainsi que les jardins envahis de ronce, les murs fissurés et les falaises, le tout en dessous de 100 mètres d’altitude. Son rayon d’action n’excède pas 400 m autour de son foyer. Son tropisme pour l’homme est supérieur à celui de P. ariasi, et ce d’autant plus qu’il s’agit d’un insecte endophile, qui pénètre volontiers dans les habitations.
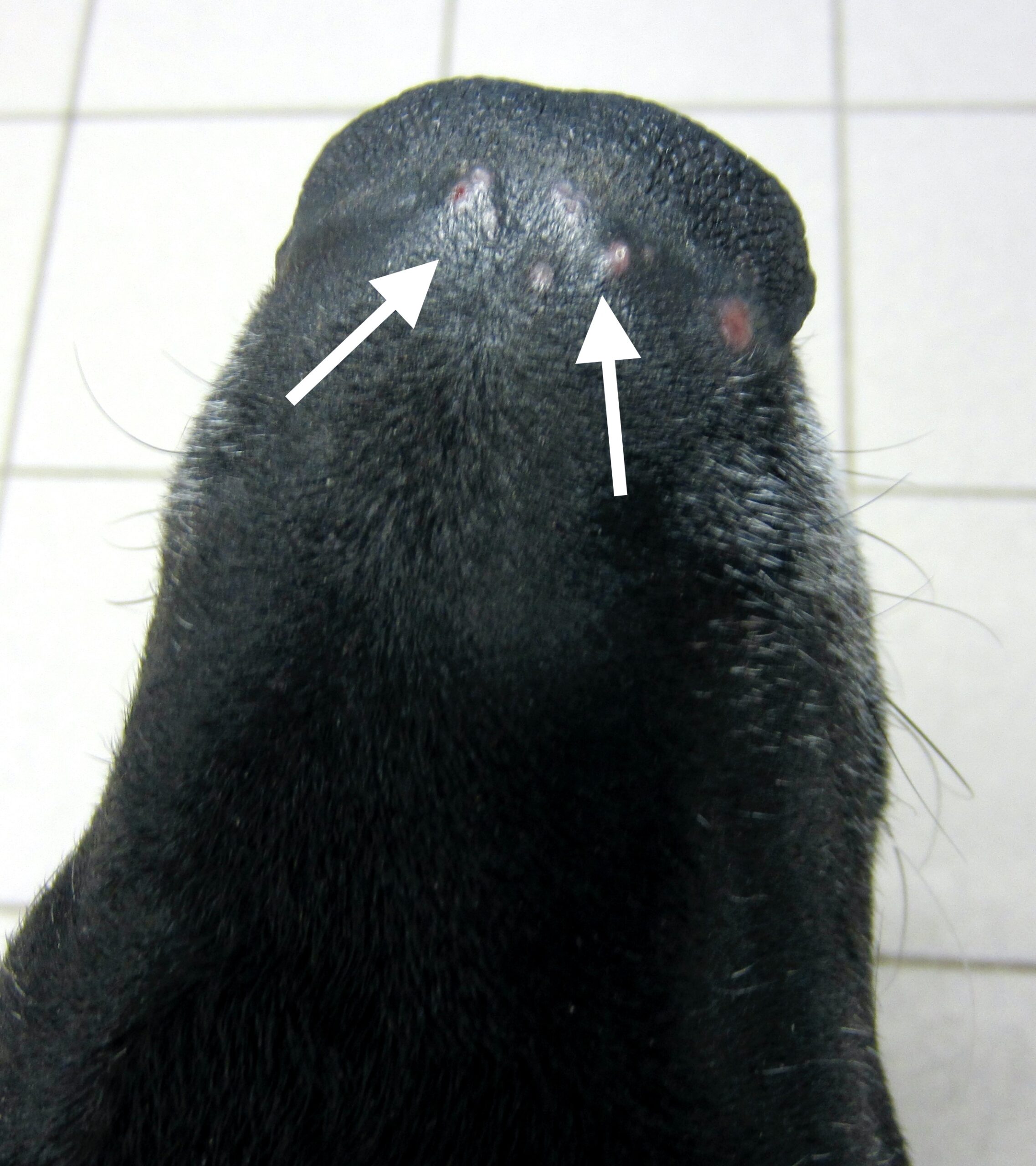
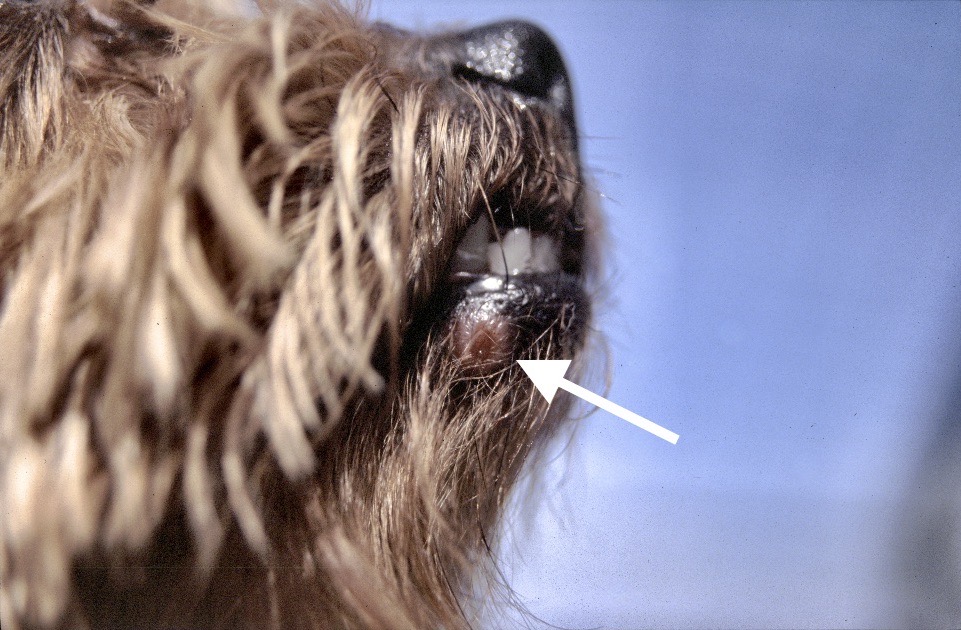
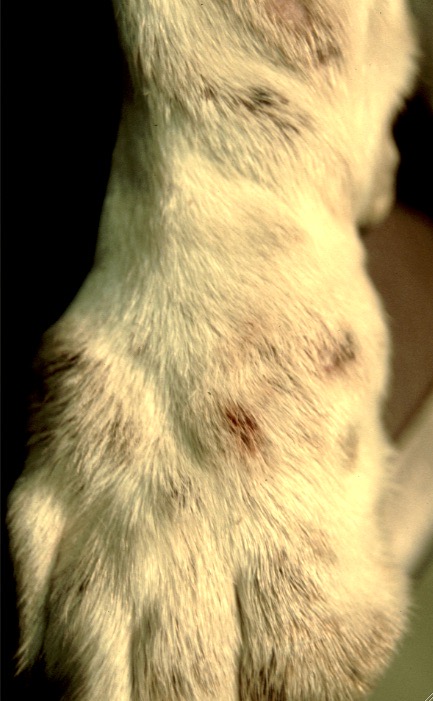
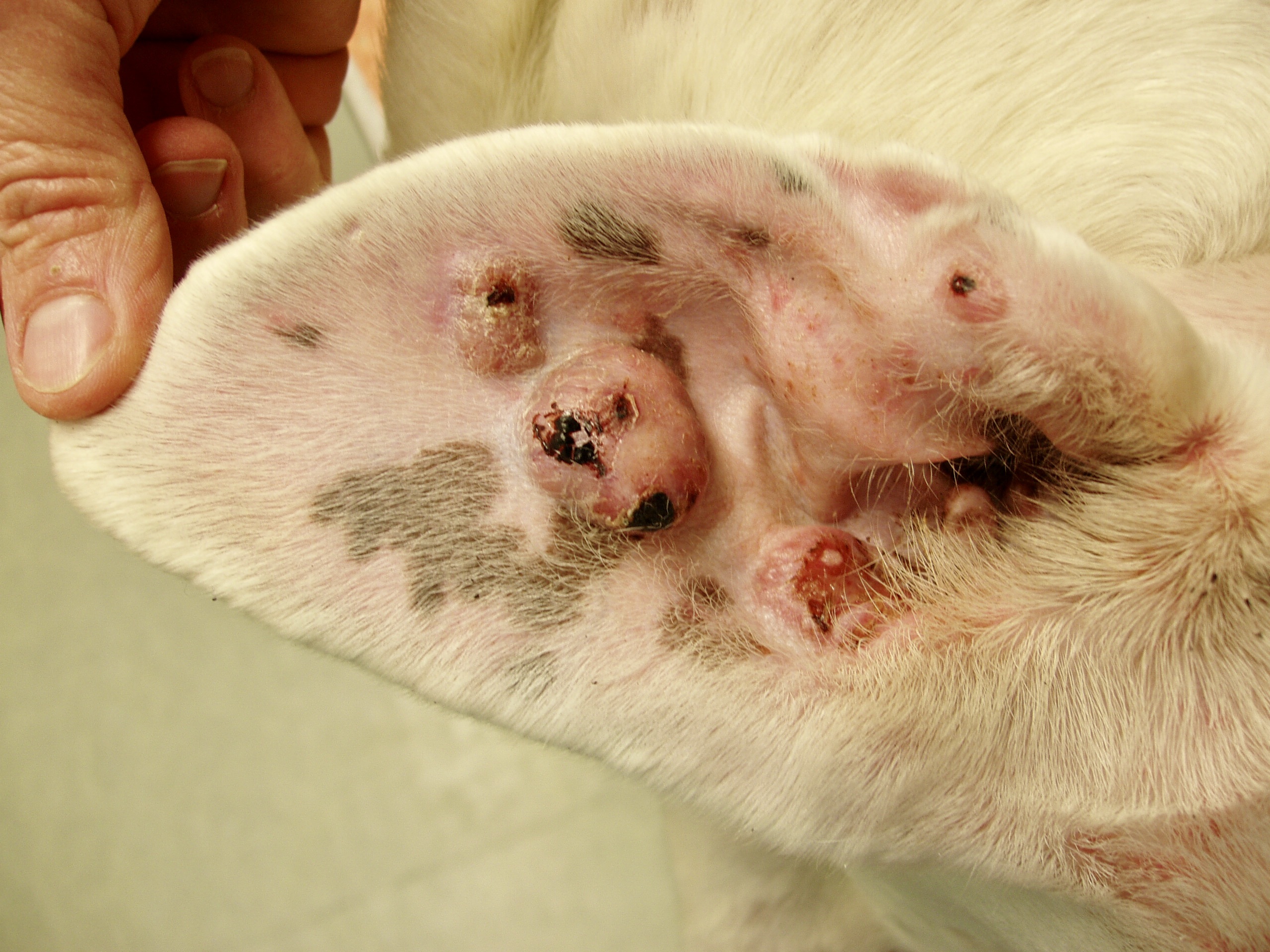
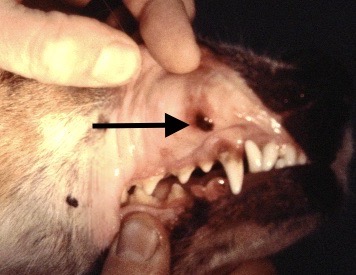
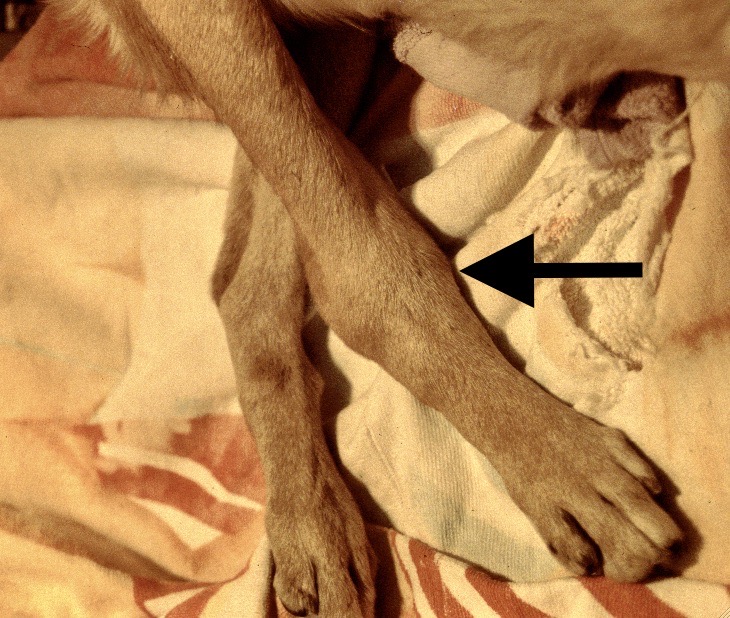
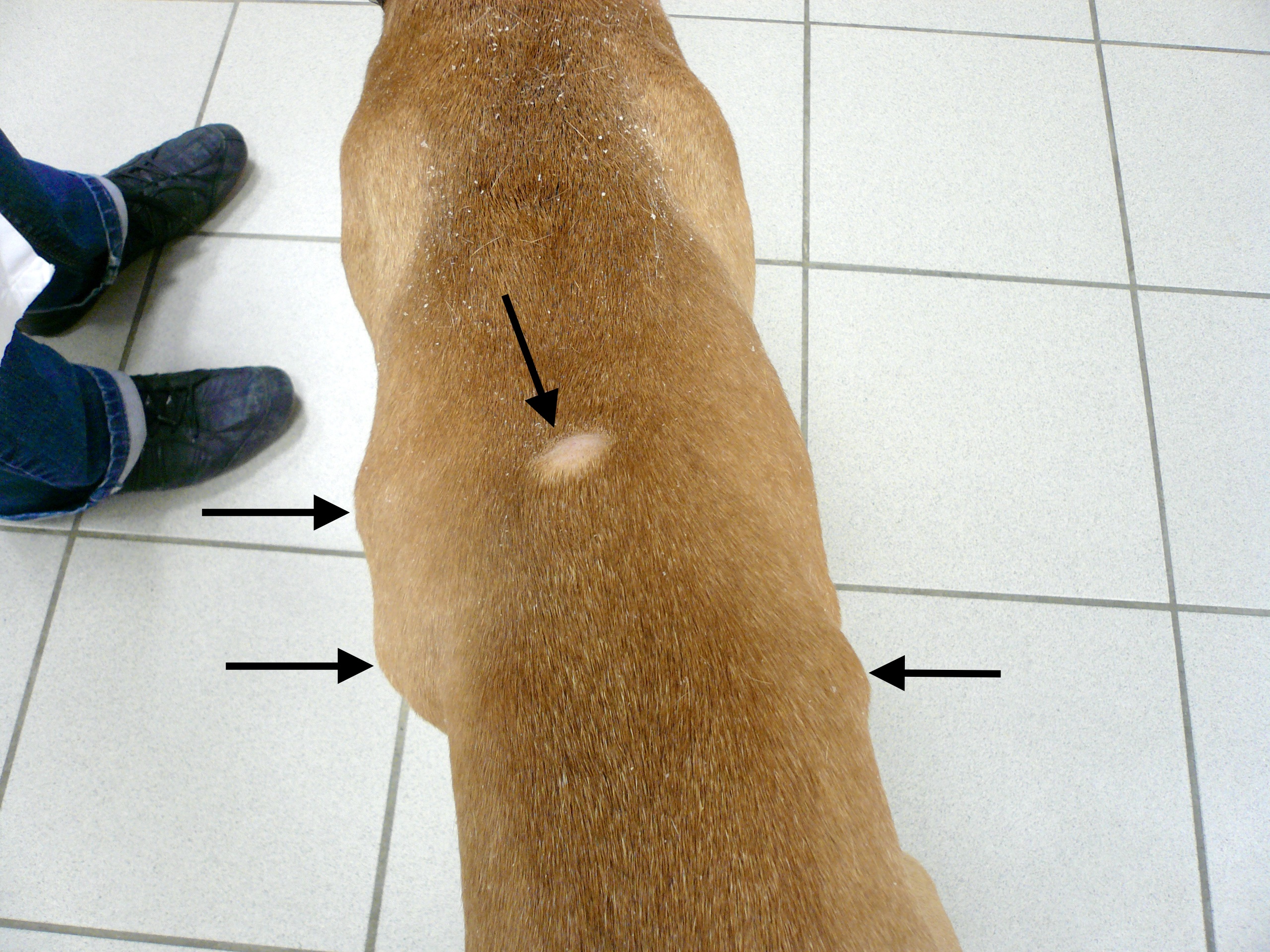
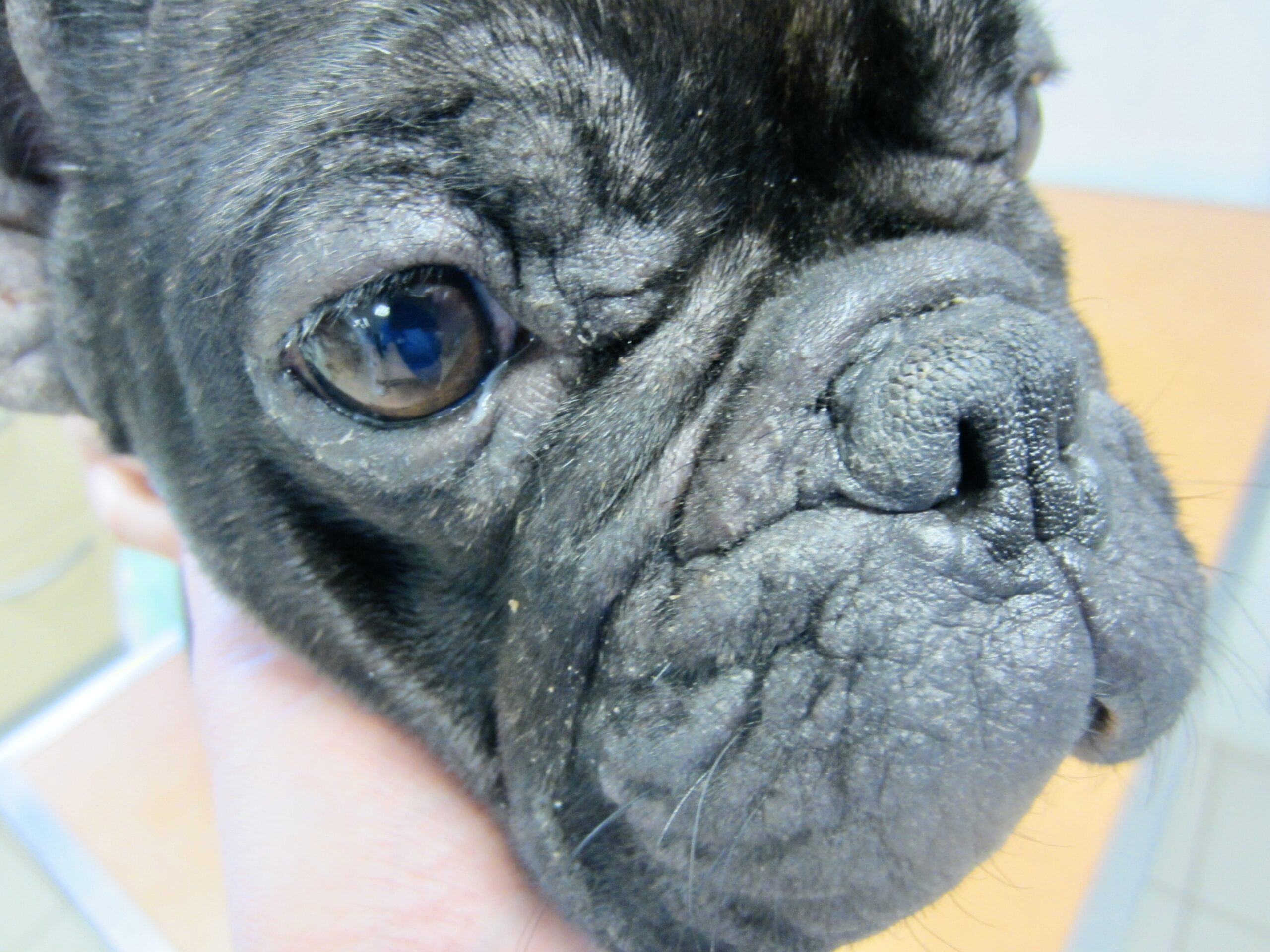
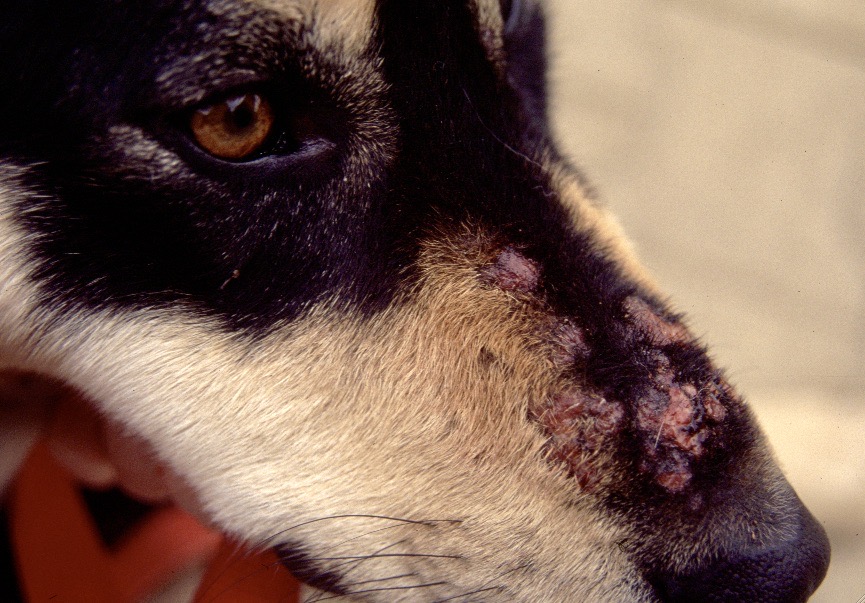
Chaque phlébotome femelle effectue plusieurs repas sanguins. L’insecte pique généralement une zône glabre de la tête de son hôte, (face interne du pavillon de l’oreille ou dessus du nez). Cette piqure est douloureuse, et dure plusieurs minutes. Un nodule d’inoculation, rempli de leishmanies, se développe quelques mois plus tard au point d’injection (Photos ci-dessus). Les chiens vivant dans les zônes de forte densité de phlébotomes définies plus haut, et passant la nuit dehors, sont plus exposés. Il n’y a pas de prédisposition en fonction du sexe, mais les boxers seraient plus souvent infectés. L’état physiologique du chien peut aussi influer sur sa sensibilité à l’infection (cf pathogénie).
Les autres modes de transmission, (in utero de la mère aux fœtus, par transfusion sanguine), sont décrits mais peu fréquents. La transmission vénérienne est suspectée, mais ne semble pas démontrée. Une contagion directe du chien à l’homme ne peut se produire que dans des conditions exceptionnelles.
4 – Et l’Homme, dans tout ça ?
Les leishmanies peuvent infecter les humains : dans certaines régions du monde (Amérique latine, Maghreb, Afrique sub-saharienne…), les cas d’infection humaine sont nombreux, et les symptômes parfois extrêmement sévères. Selon un rapport de l’OMS en 2021, le nombre de cas de leishmaniose humaine en 2020 dans le monde s’élevait à 208 357 cas pour la leishmaniose cutanée et 12 838 cas pour la leishmaniose viscérale, le tout ayant entraîné 347 décès – ce qui semble étonnamment bas, au regard du nombre de personnes infectées. A noter que des chiffres beaucoup plus élevés avaient été publiés en 2012, en tenant compte du fait que de nombreux cas de leishmaniose humaine ne seraient pas déclarés. Les auteurs estimaient le nombre réel de cas par an entre 700 000 et 1,2 millions pour la leishmaniose cutanée, 200 000 à 400 000 pour la leishmaniose viscérale, avec 20 000 à 40 000 décès annuels directement liés à la leishmaniose. Ces chiffres ont été revus à la baisse dans une étude de 2017, avec encore tout de même une estimation de 50 000 à 90 000 cas annuels de leishmaniose viscérale.
On n’en est heureusement pas là dans nos régions, les leishmanies gardoises et héraultaises (françaises en général), se montrant visiblement plus méchantes pour les chiens que pour l’Homme. Selon une publication du Bulletin épidémiologique de l’Université Montpellier 1 et du CHRU de Montpellier, on a recensé entre 1999 et 2009, quinze cas de leishmaniose humaine autochtone dans le département de l’Hérault, et quinze dans le département du Gard, soit environ un cas (précisément 1,36) par an pour chacun de ces départements. En France métropolitaine en général, 517 cas autochtones ont été recensés entre 1998 et 2020, soit une moyenne de 23,5 cas par an. A noter que ces chiffres sont en régression depuis 1999, la baisse du nombre de cas étant attribuée à la diminution parallèle du nombre de personnes vivant avec le VIH (voir le paragraphe suivant).
Faut-il donc s’inquiéter si l’on habite en limite de Cévennes, au milieu des chênes verts, et que tous les chiens des voisins ont attrapé la leishmaniose ? La réponse est clairement non : avec un cas de leishmaniose humaine par an et par département… ça ne serait vraiment pas de chance que ça tombe sur vous ! Même chose si l’on a un chien leishmanien à la maison, surtout s’il est traité. Seules exceptions : les personnes souffrant d’un déficit de l’immunité, à cause d’une maladie ou d’un traitement… éventuellement les nourrissons. En cas de doute, demandez de toute façon conseil à votre médecin. Mais en tout état de cause, avec un cas de leishmaniose humaine par an et par département, on court beaucoup plus de risques en prenant sa voiture le matin, qu’en passant la soirée dans les Cévennes, sous les chênes verts. (A fortiori si l’on utilise un répulsif anti-moustiques !)
Pathogénie
Passage un peu technique… mais intéressant à lire si l’on veut comprendre la maladie, et en quoi consiste le vaccin. Sinon, il est tout à fait permis de zapper !
La réponse immunitaire à l’infection leishmanienne, d’abord décrite chez la souris puis étendue à l’espèce canine, est mieux connue depuis quelques années. Elle repose sur la dualité entre deux populations de lymphocytes T helper (Th1 et Th2), qui coexistent chez un même individu, mais avec prédominance de l’une par rapport à l’autre selon les chiens. Les cellules Th1 produisent de l’interleukine 2 (IL2), de l’interféron g (IFN g), et du tumor necrosis factor (TNF), et interviennent dans l’immunité à médiation cellulaire. (En particulier, les Lymphocytes T CD4+ activés produisent l’IFN g, qui stimule les macrophages à détruire les leishmanies). Cette immunité cellulaire permet de résister à l’infection. A contrario, le nombre de cellules CD4+ circulantes et le rapport CD4+/CD8+ s’effondrent pendant la maladie, et leur diminution semble corrélée à la sévérité des symptômes. Les chiens sont aussi d’autant plus infectieux pour les phlébotomes qu’ils ont des taux de CD4+ faibles.
Les cellules Th2 produisent les interleukines 4, 5, 6, 10 et 13, et stimulent la différentiation des cellules B et la production d’anticorps, à l’origine d’une hypergammaglobulinémie. Ces anticorps ne sont pas protecteurs, et favorisent au contraire le développement de la maladie par dépôts d’immuns complexes, à l’origine de vascularites, polyarthrites, ulcérations cutanéo-muqueuses (une des causes des saignements de nez que nous verrons un peu plus loin), uvéites et glomérulonéphrites. La présence d’anticorps dirigés contre la membrane des plaquettes est également décrite.
Outre la réponse immunitaire, la génétique intervient dans la résistance à la maladie : les chiens sensibles à l’infection leishmanienne présentent une mutation sur le gène RAMP1, qui empêche le contrôle de la replication des leishmanies à l’intérieur des macrophages. Il a aussi été montré que certaines races de chiens (Ibizian hounds) présentent une immunité à prédominance cellulaire, et une réponse immune efficace contre la leishmaniose.
Par ailleurs, comme on l’a vu plus haut, le développement du diagnostic moléculaire par PCR nous a appris que la prévalence de l’infection leishmanienne est beaucoup plus importante que la prévalence de la maladie ou de la séropositivité, de nombreux chiens infectés ne présentant aucun symptôme et demeurant séronégatifs.
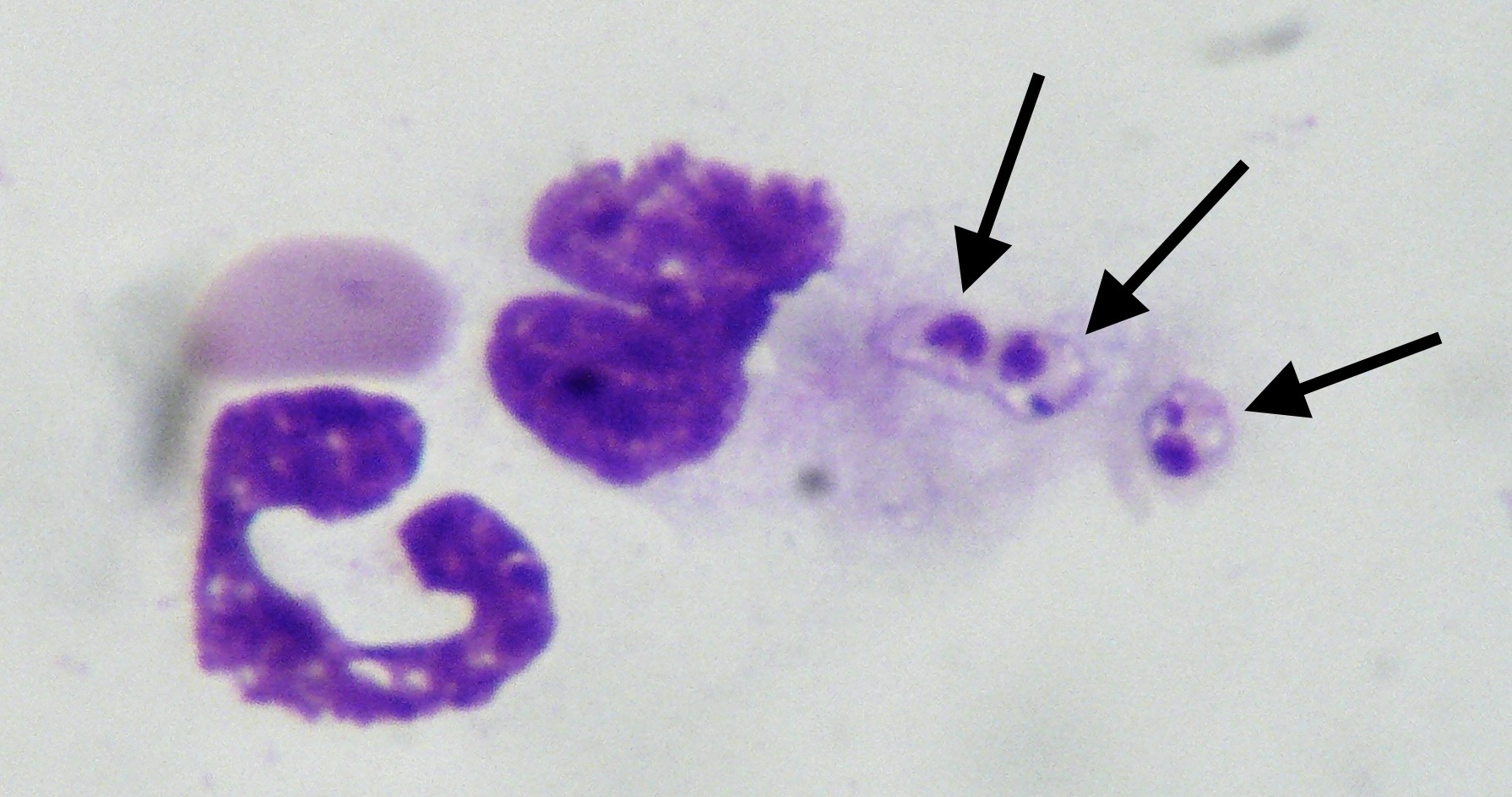
On détecte des leishmanies dans le sang par des techniques très sensibles (PCR), mais il est rare d’en trouver sur un simple frottis sanguin : on peut imaginer que les défenses du chien qui a fourni cette goutte de sang n’étaient pas au top, et qu’il avait une réponse immunitaire de type humoral (Th2) plutôt que cellulaire (Th1) !
Ces nouvelles connaissances, (bon, on continue à dire « nouvelles », mais elles commencent maintenant à dater un peu !), nous conduisent à passer d’une ancienne conception de la leishmaniose, (la maladie est le résultat de l’infection parasitaire), à une nouvelle conception (la maladie est la conséquence d’une réponse immunitaire inadéquate à l’infection).
D’autres enseignements et conséquences pratiques peuvent être tirés de ces nouvelles connaissances :
– La prévalence de l’infection est beaucoup plus forte que ce qui était estimé traditionnellement : on est passé d’une séroprévalence de 5-15%, voire 30% dans certaines populations de chiens cévenols, à 80% dans ces mêmes populations, lorsque le dépistage se fait par PCR.
– La plupart des chiens infectés ne développeront pas la maladie (prévalence de la maladie parmi les chiens infectés : 3 à 10%). Mais du coup… que penser d’un chien ne présentant pas de symptômes, mais positif pour la leishmaniose en sérologie ou par PCR ? (ce qui est le cas, on l’a vu, de très nombreux chiens). Et surtout, faut-il le traiter ? Pour la première question, il est conseillé de croiser différents tests (sérologie, PCR, mise en évidence directe de leishmanies, répercussions sur un bilan sanguin…) pour évaluer les conséquences de l’infection sur le chien… et de toute façon, de le surveiller de près ! Pour la deuxième question, on a vu plus haut que de nombreux chiens asymptomatiques ont des leishmanies qui se promènent dans le sang, et constituent donc un bon réservoir pour les phlébotomes ; et qu’en revanche, une fois traités, ces chiens sont beaucoup moins, voire plus du tout infectants pour les phlébotomes. Donc… plutôt traiter, mais la décision est bien sûr à prendre au cas par cas.
– Les chiens infectés sans signe clinique montrent une réponse immunitaire de type cellulaire (Th1) contre la leishmaniose. Ils sont généralement séronégatifs, ou faiblement séropositifs.
– Les chiens infectés malades montrent une réponse immunitaire de type humoral (Th2) contre la leishmaniose, et une réponse cellulaire faible. Ces chiens sont généralement très immunodéprimés, avec de très faibles taux de CD4+ circulants.
– Un chien peut passer d’un statut sensible à un statut résistant et réciproquement, en fonction des prises de médicaments, infections, infestations parasitaires, tumeurs, etc. Devant un chien leishmanien, il sera donc intéressant de demander aux propriétaires si Médor ne prend pas actuellement un médicament immunosuppresseur, ou chercher s’il n’est pas atteint d’une maladie intercurrente, d’un parasitisme… on trouve de nombreux exemples de telles co-infections dans la littérature scientifique.
Signes cliniques
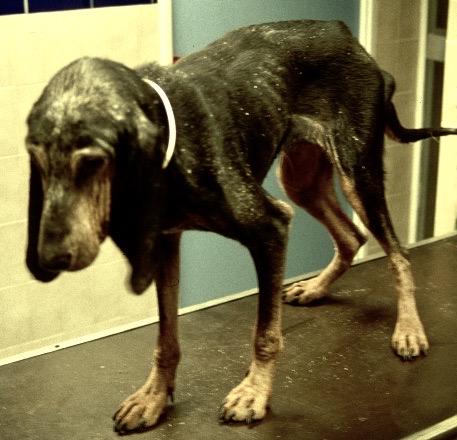
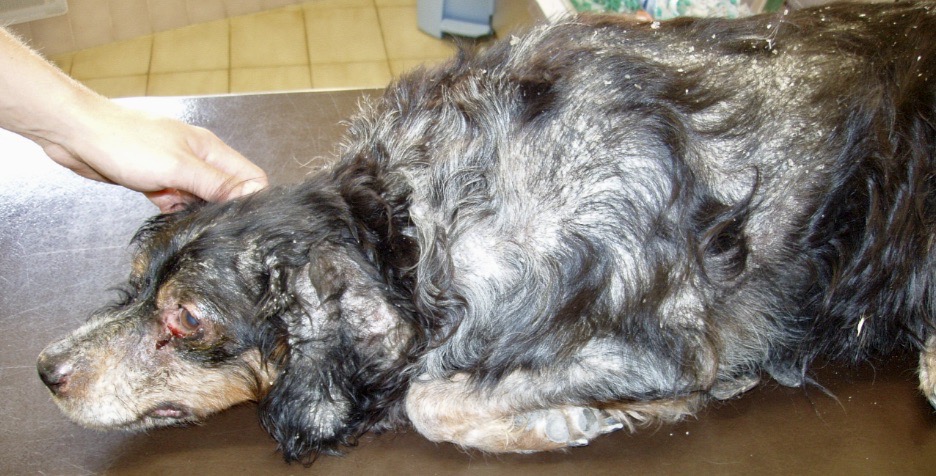
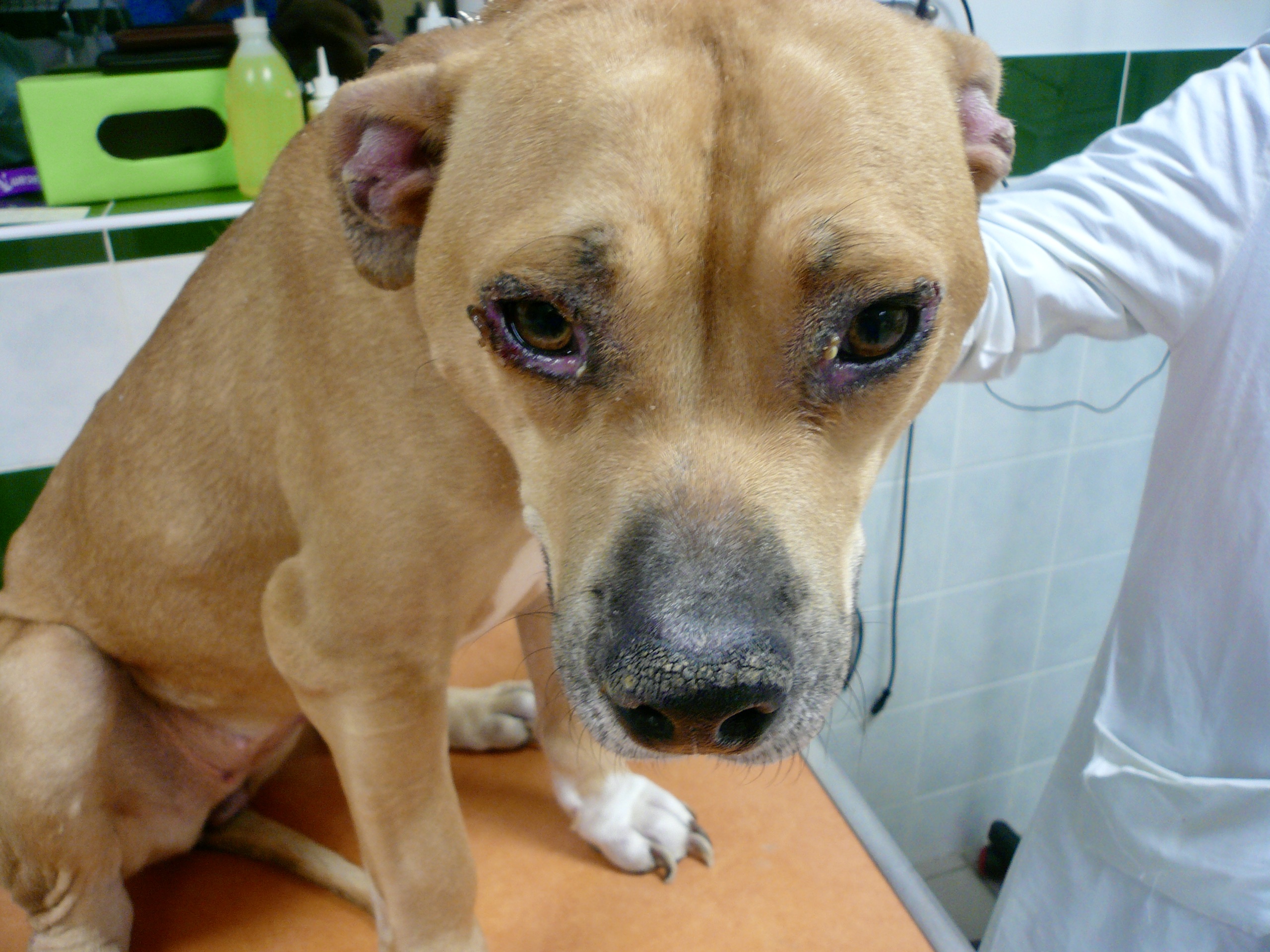
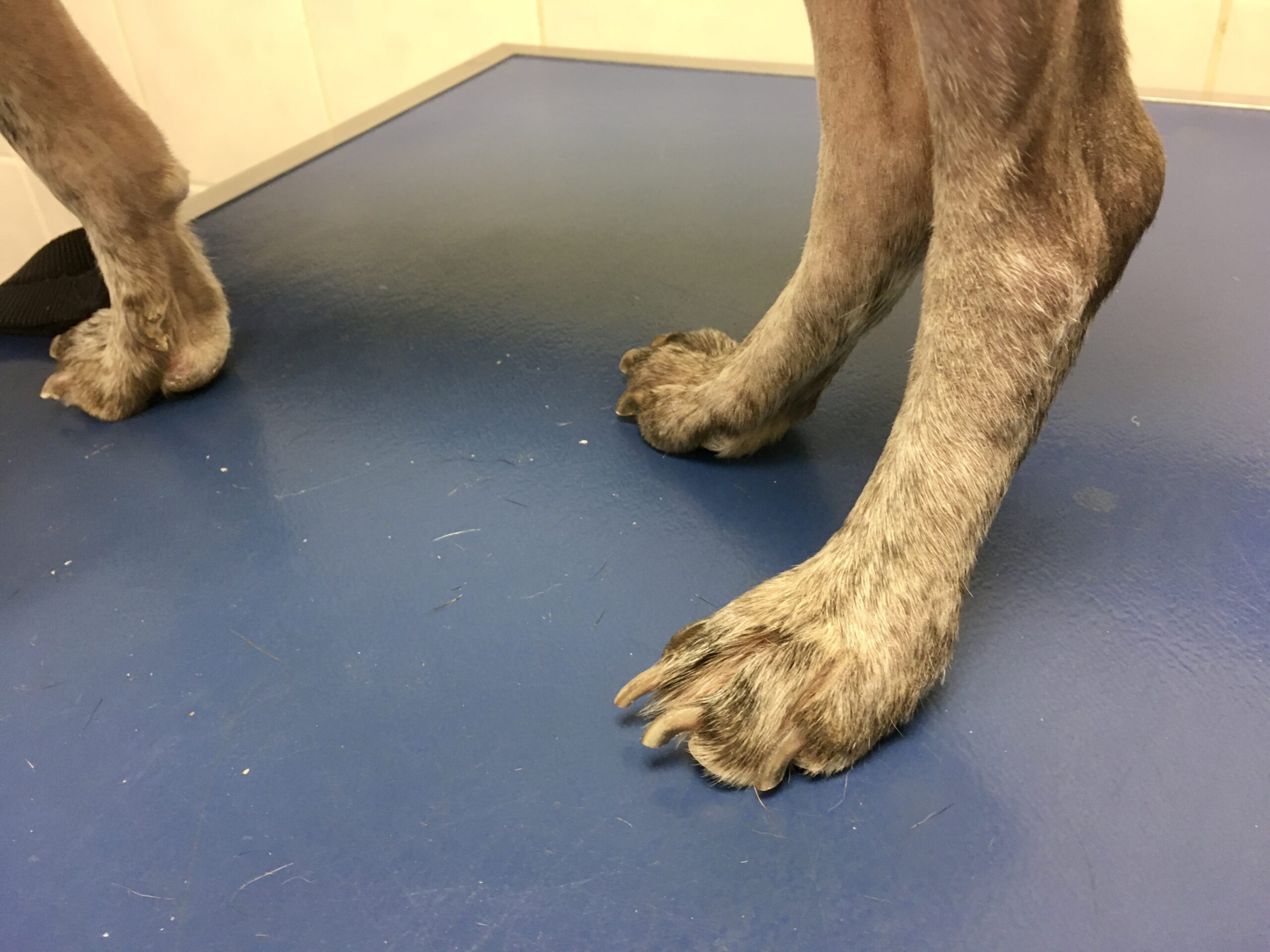
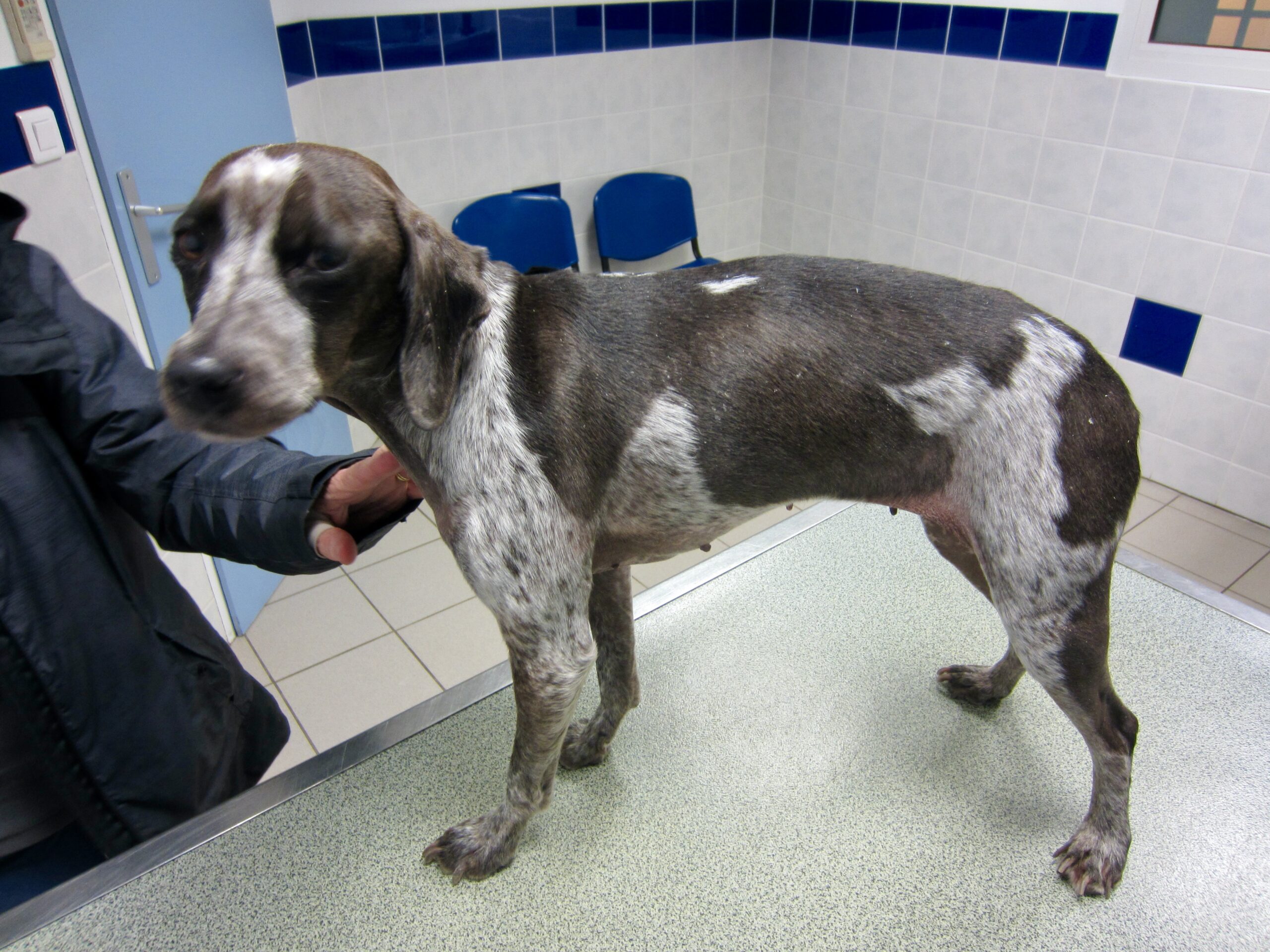
La photo n’est pas jeune, il faut dire qu’heureusement, on ne voit pas (ou plus) beaucoup de chiens arrivés à ce stade de la maladie ! Outre l’état d’extrême cachexie, les douleurs (ou la « simple » faiblesse musculaire ?) que l’on devine d’après la position des membres, noter le squamosis, qui a recouvert la table de « pellicules » en quelques minutes. Le pauvre chien a quand même pu être mis sous traitement.
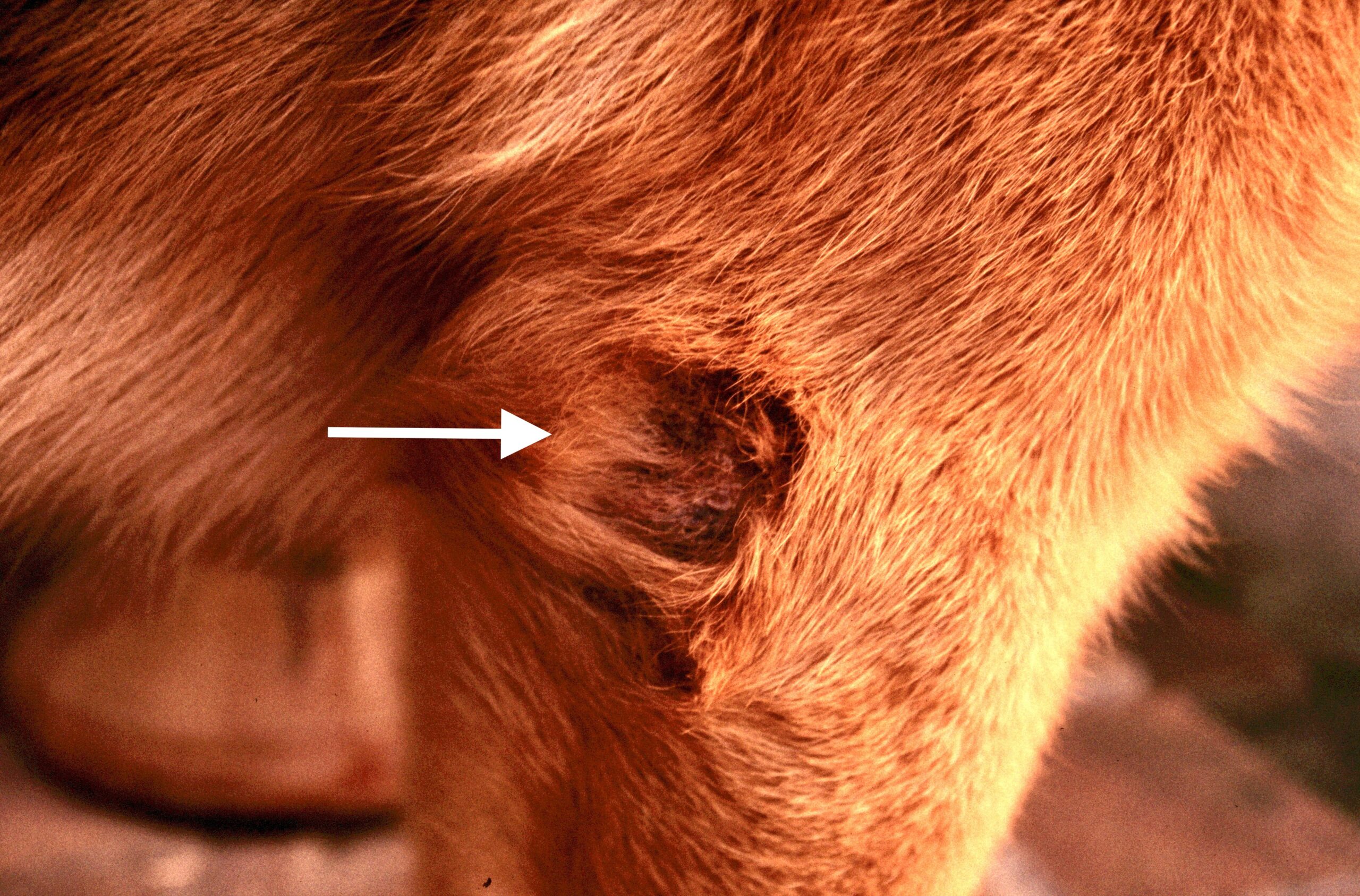
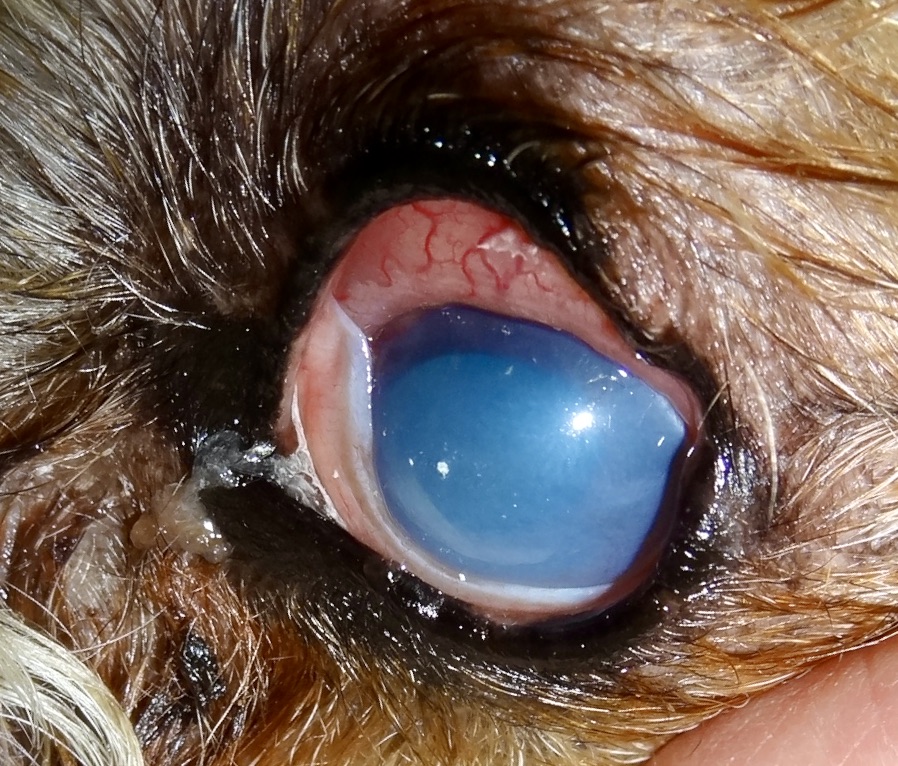
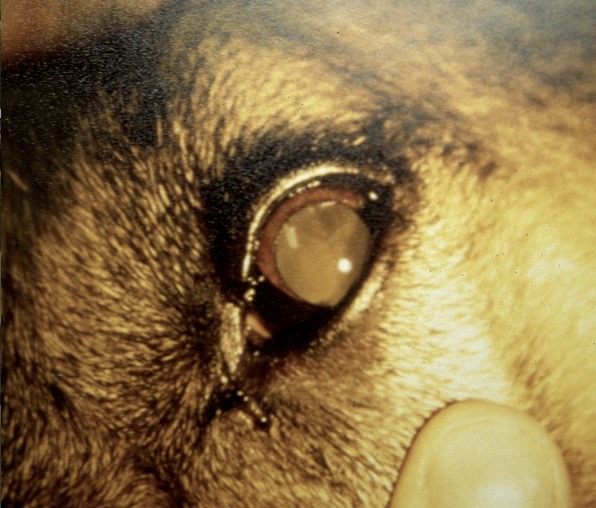
Dans les 2 à 3 mois suivant la fin de la période d’activité des phlébotomes, un chancre d’inoculation est souvent visible chez les chiens contaminés : il s’agit d’abord d’une petite surélévation rouge, puis d’une lésion ulcéro-croûteuse, cernée par un bourrelet œdémateux, et pouvant atteindre 2 à 3 cm de diamètre. Cette lésion est présente au niveau de la truffe, du chanfrein, et de la face interne des oreilles des chiens. Elle disparaît en moyenne après 6 mois. Suit une période d’incubation pouvant varier de 3-12 mois à 4-6 ans selon les auteurs, à l’issue de laquelle un certain nombre de chiens développeront la maladie. Les principaux signes cliniques observés sont énumérés ci-après. Ils évoluent généralement sous une forme chronique, une évolution aiguë avec fièvre étant observée dans 4% à 23% des cas. On citera en particulier :
1 – Des symptômes généraux :
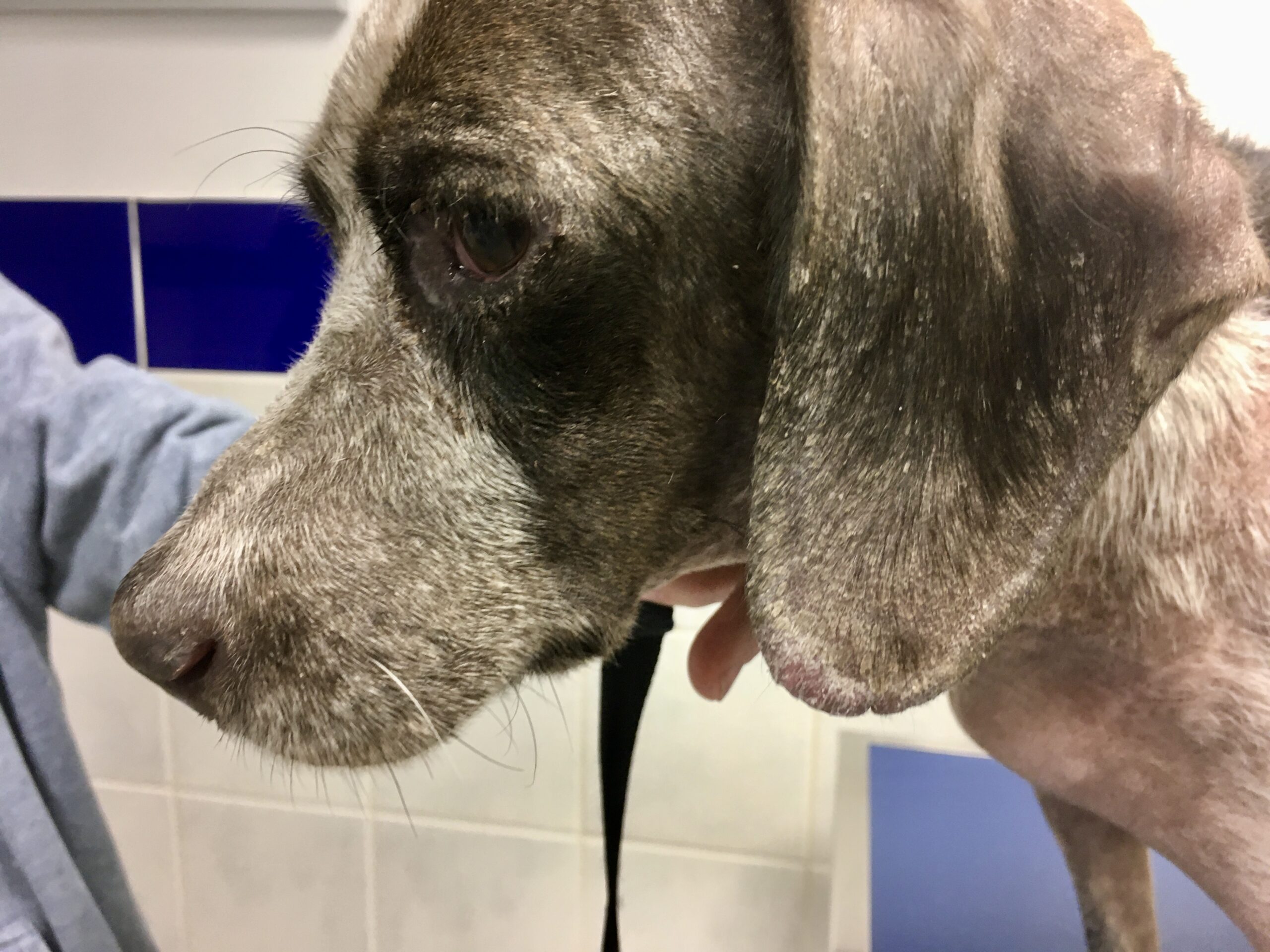
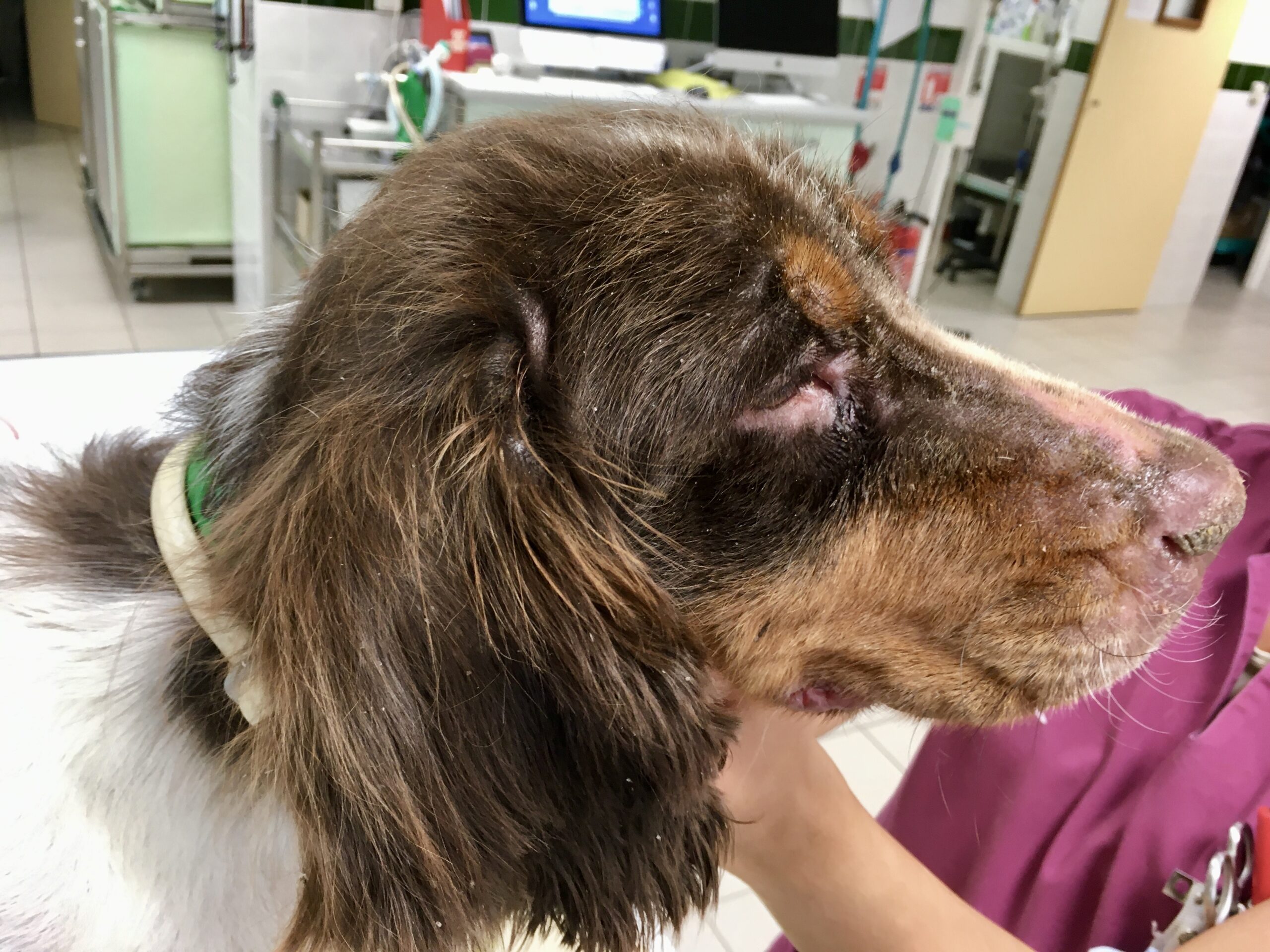
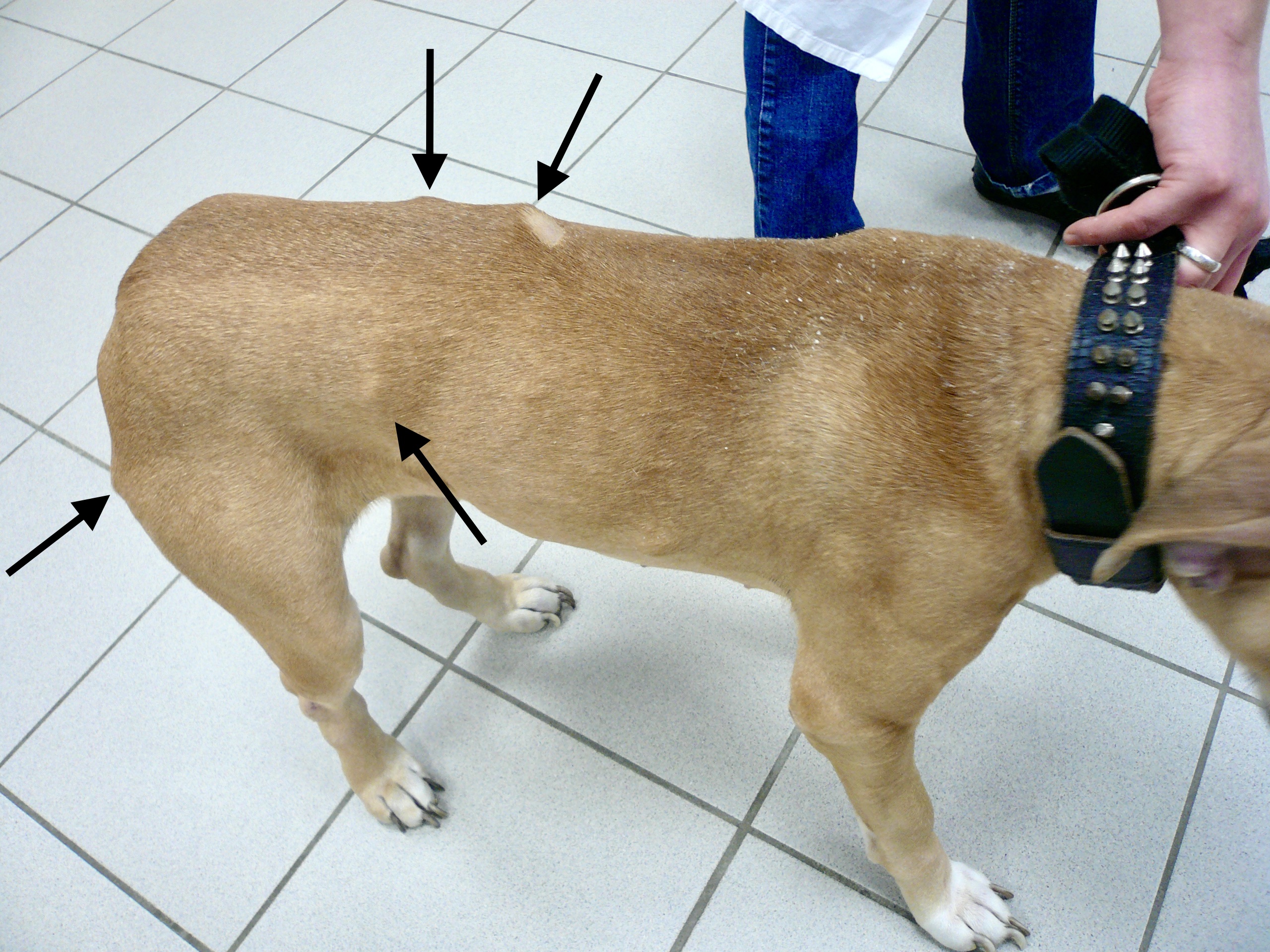
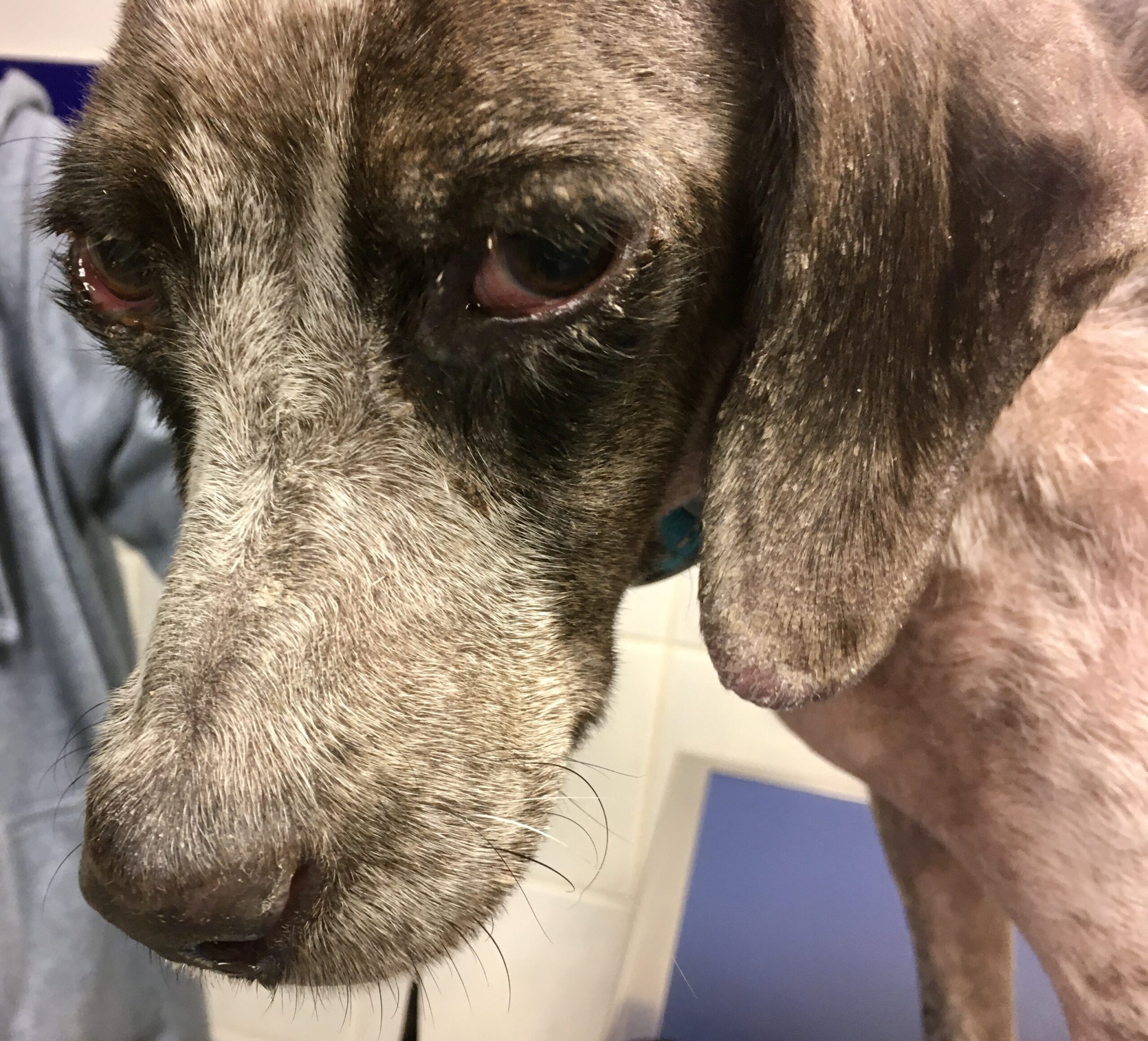
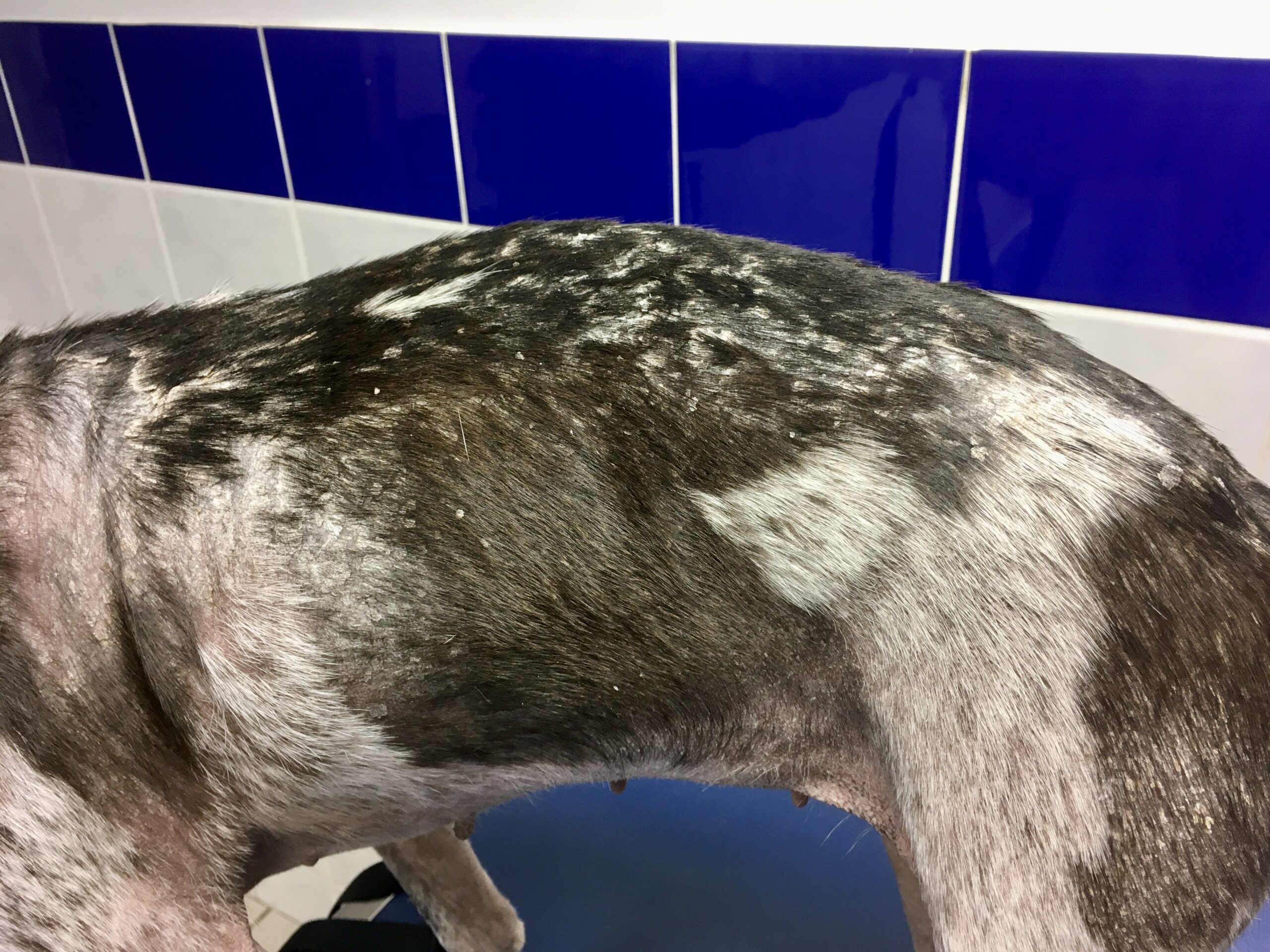
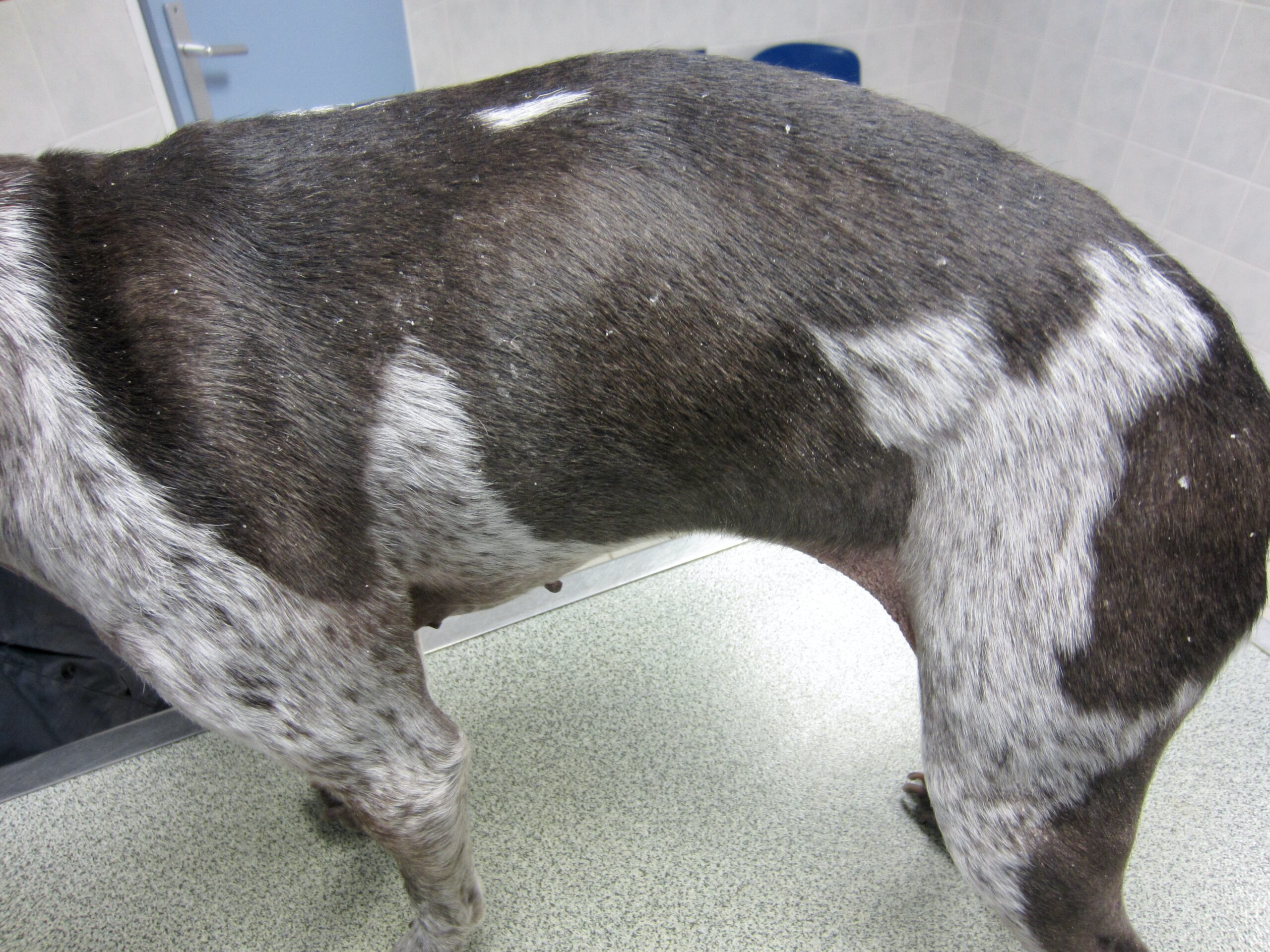
Le pauvre chien ci-dessus en est une illustration extrême, et celui en tout début d’article n’était pas mal non plus, quoique tout de même loin d’en être au même stade : amaigrissement, baisse d’appétit, abattement ; le chien est triste et ne joue plus : les propriétaires ont souvent l’impression que leur chien « a pris un coup de vieux ». Impression renforcée par une fonte musculaire, d’abord sur la tête, (creusement des fosses temporales qui donne un aspect de vieux chien), puis sur l’ensemble du corps.
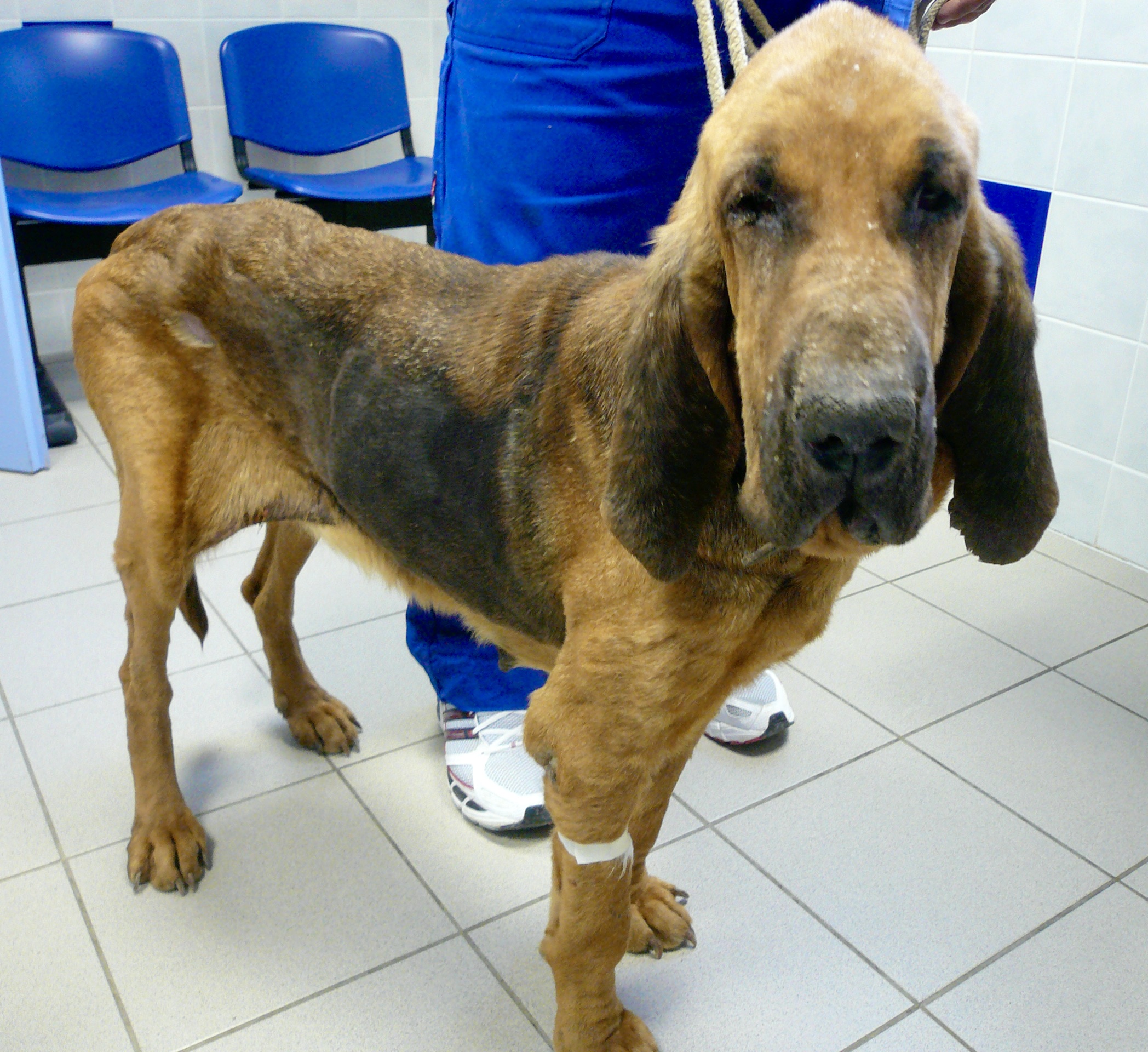
Amaigrissement, fonte musculaire, notamment au niveau de la tête : voici trois toutous qui ont un aspect de vieux chien, alors qu’aucun des trois n’est si vieux que ça. En plus ici, les dépilations autour des yeux qui leur donnent un air tristoune ne contribuent pas à les rajeunir !
La suite des symptômes – et il y en a ! – en cliquant sur les petits boutons ci-dessous. Attention, certaines images pourraient heurter les lecteurs sensibles !
Signes biologiques :
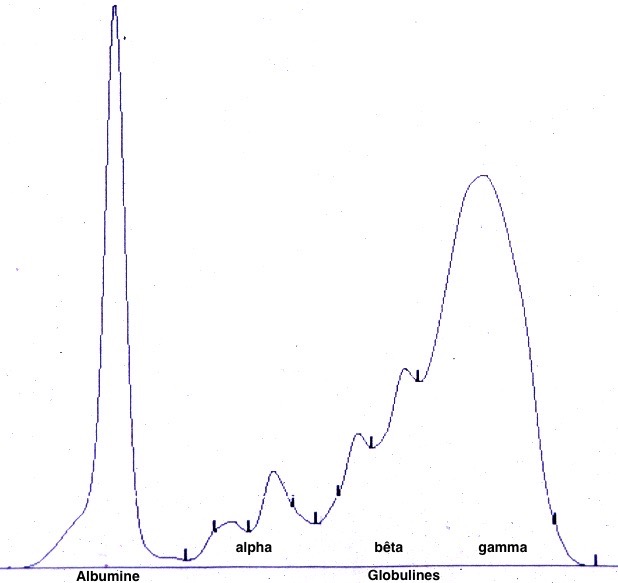
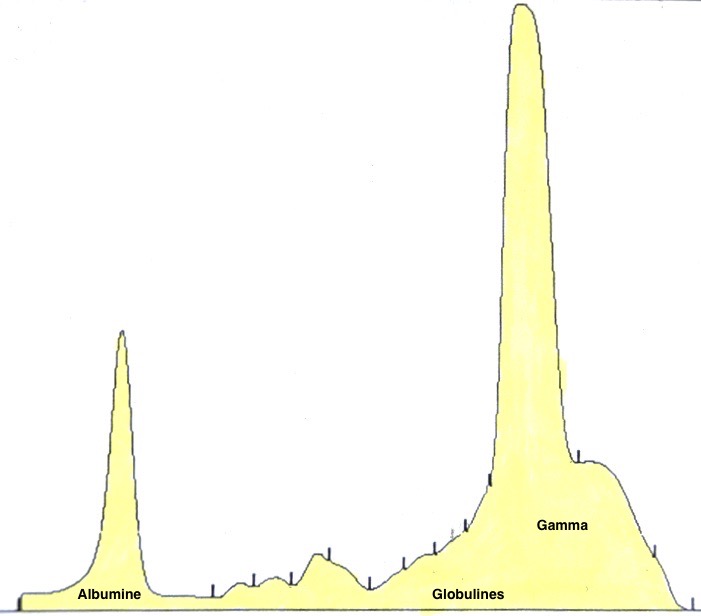
La principale modification biochimique chez les chiens leishmaniens est une hyperprotidémie (= augmentation du taux de protéines sanguines). Quelques bases à connaître pour bien profiter de la suite : il existe deux grandes catégories de protéines dans le sang : l’albumine, qui joue un rôle important dans l’organisme, en transportant un certain nombre de substances (vitamines, hormones etc), et en évitant les pertes d’eau grâce à son pouvoir osmotique. Et les différentes globulines, dont les alpha 2 (marqueur de l’inflammation aiguë) et les bêta et gamma, qui augmentent plutôt lors d’inflammations chroniques.
Maintenant, rappelons-nous un peu la pathogénie de la leishmaniose, avec les chiens Th1 qui se protègent efficacement grâce à leur immunité de type cellulaire, et les Th2, qui produisent de grandes quantités d’anticorps inutiles, (les anticorps, pour faire court, ce sont les gammaglobulines), ce qui laisse le champ libre aux leishmanies pour se multiplier, ce qui conduit le chien à fabriquer encore plus d’anticorps/gammaglobulines toujours aussi inutiles, (voire délétères), et ainsi de suite. Le résultat, c’est que quand on se penche sur les quantités respectives des différentes protéines chez un chien leishmanien, (à l’aide d’une analyse appelée électrophorèse : on va en voir des exemples), on a dans la plupart des cas des globulines élevées, voire très élevées, et une albumine diminuée (notamment parce qu’elle s’échappe dans les urines, mais on en reparlera un peu plus loin). Globalement, l’un dans l’autre, le taux de protéines totales (somme de l’albumine un peu diminuée et des globulines augmentées), est le plus souvent élevé dans la leishmaniose canine.
Bon, et à quoi ça sert, de savoir tout ça, me demanderez-vous ? D’abord, quand on fait un bilan et qu’on trouve un taux de protéines très élevé, (85, 90, 100 g/l voire davantage, les valeurs usuelles étant dans les 55-75 g/l)… on se dit qu’il y a anguille sous roche, et on va chercher spécifiquement un certain nombre de maladies connues pour faire grimper la protidémie, dont la leishmaniose, l’ehrlichiose, certains cancers… et en parallèle, on va demander une électrophorèse, parce que ça peut aider de savoir quelle(s) globuline(s) est (ou sont) augmentée(s), et dans quelles proportions. Et puis autre intérêt de l’électrophorèse, c’est le suivi du chien sous traitement, parce qu’on en parlera un peu plus loin, mais il est parfois difficile de savoir si la leishmaniose est sous contrôle chez un chien traité, et quand on voit l’albumine qui remonte et les globulines qui se normalisent… c’est très bon signe.
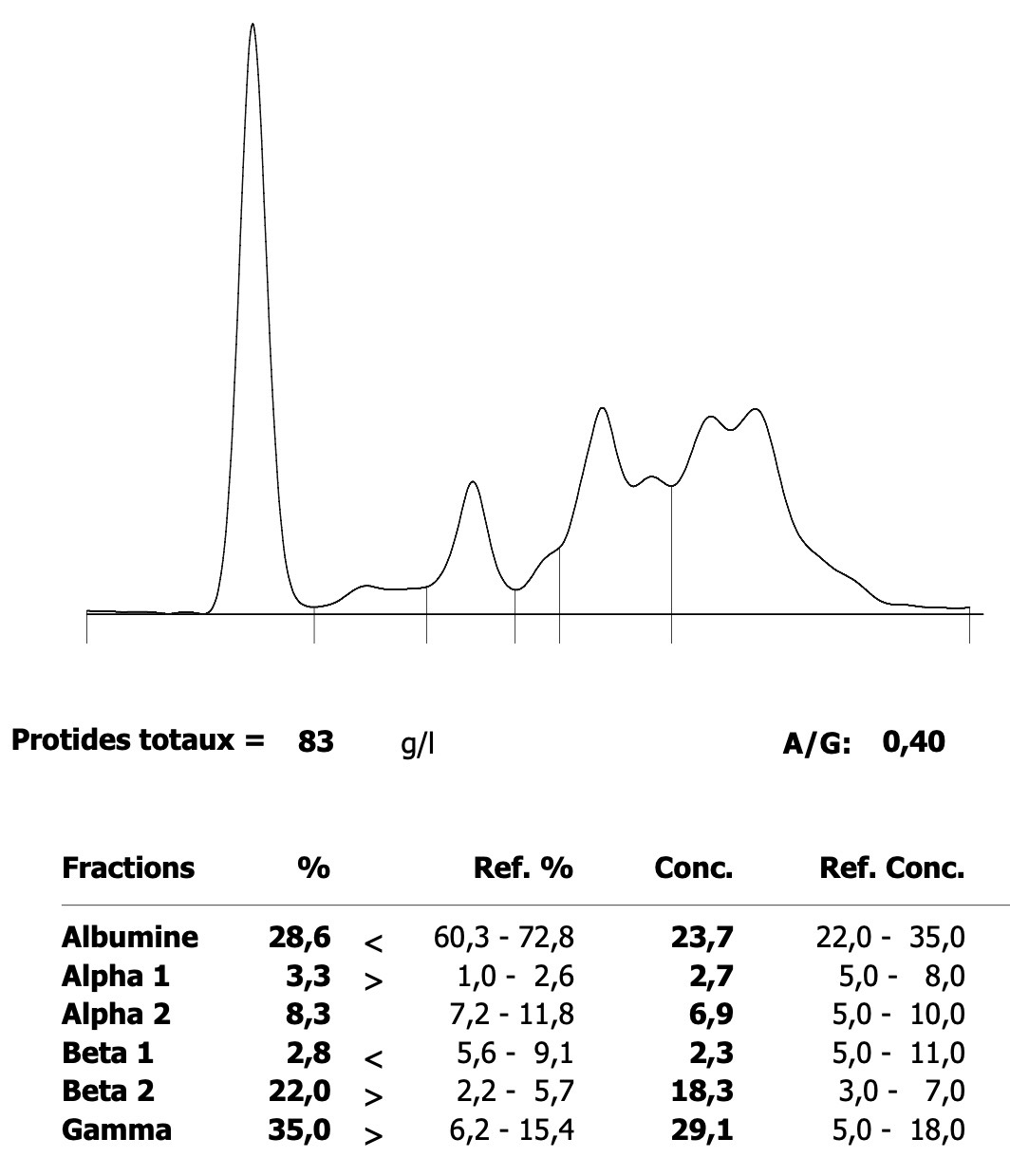
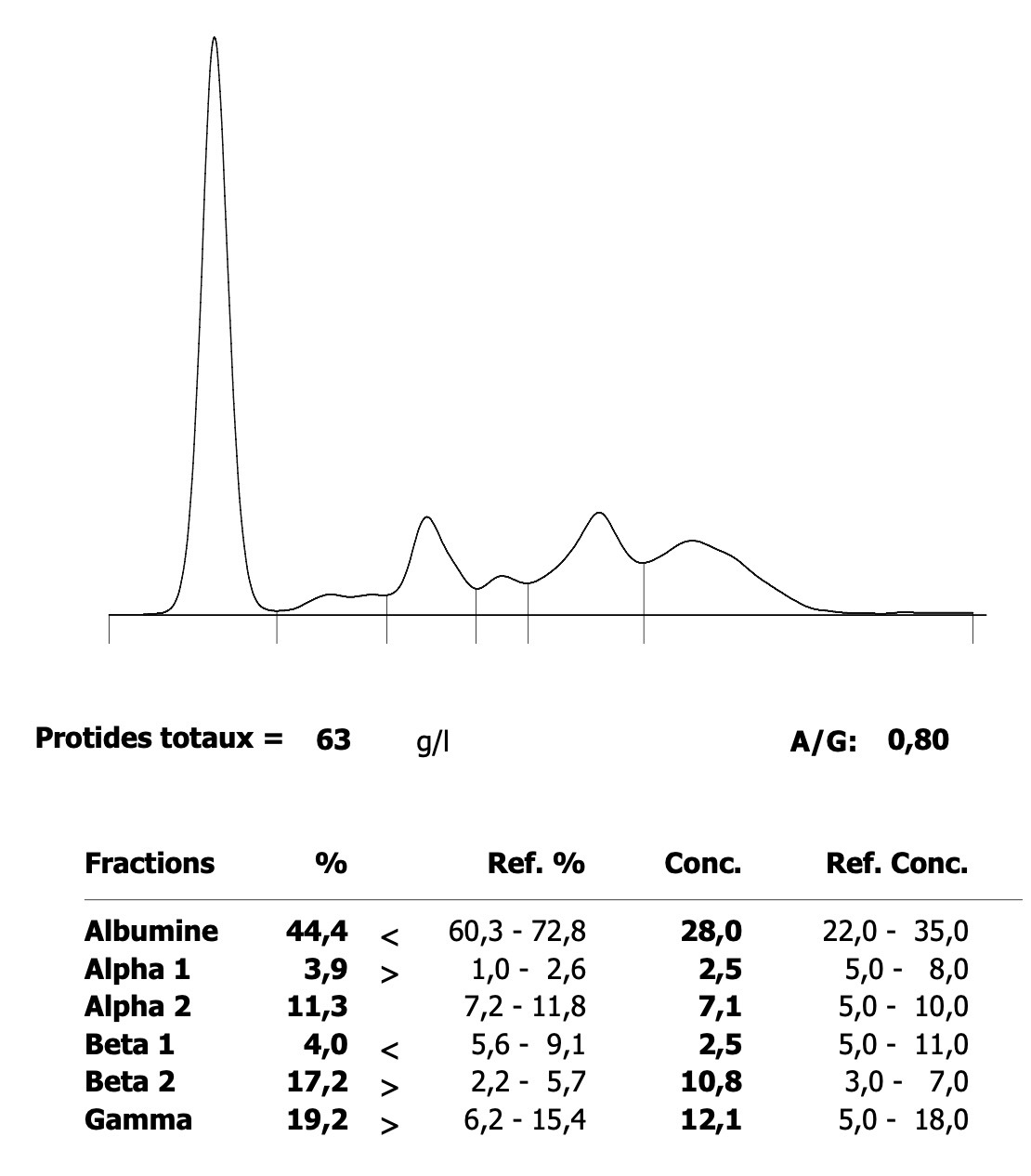
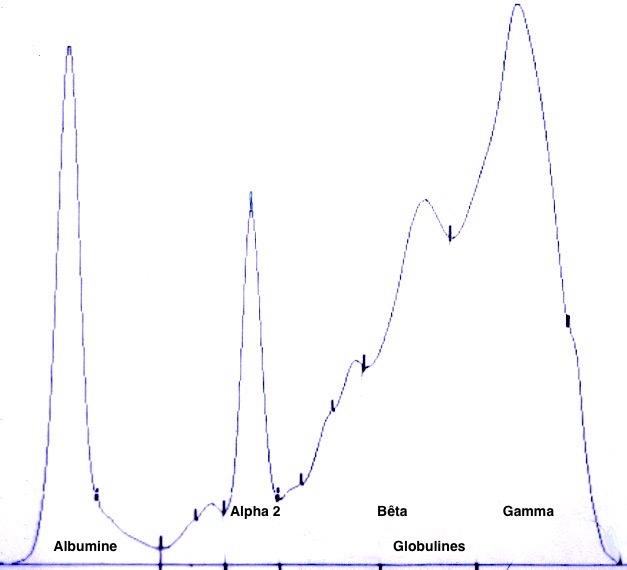
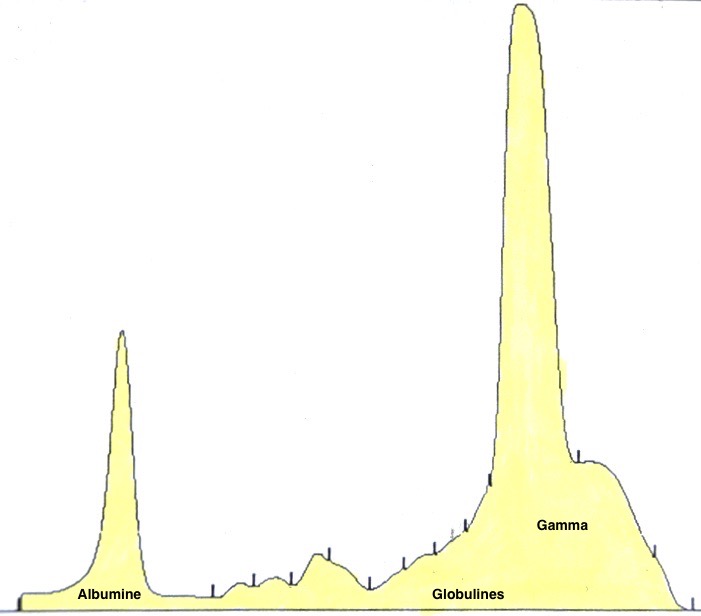
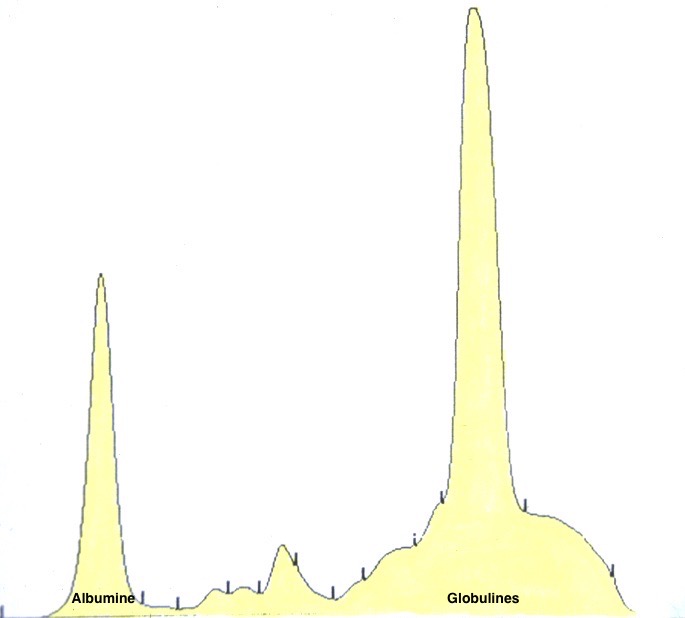
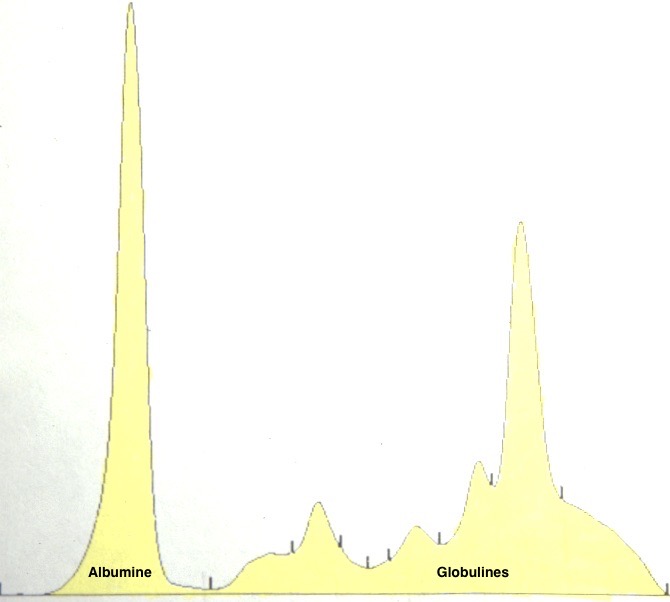
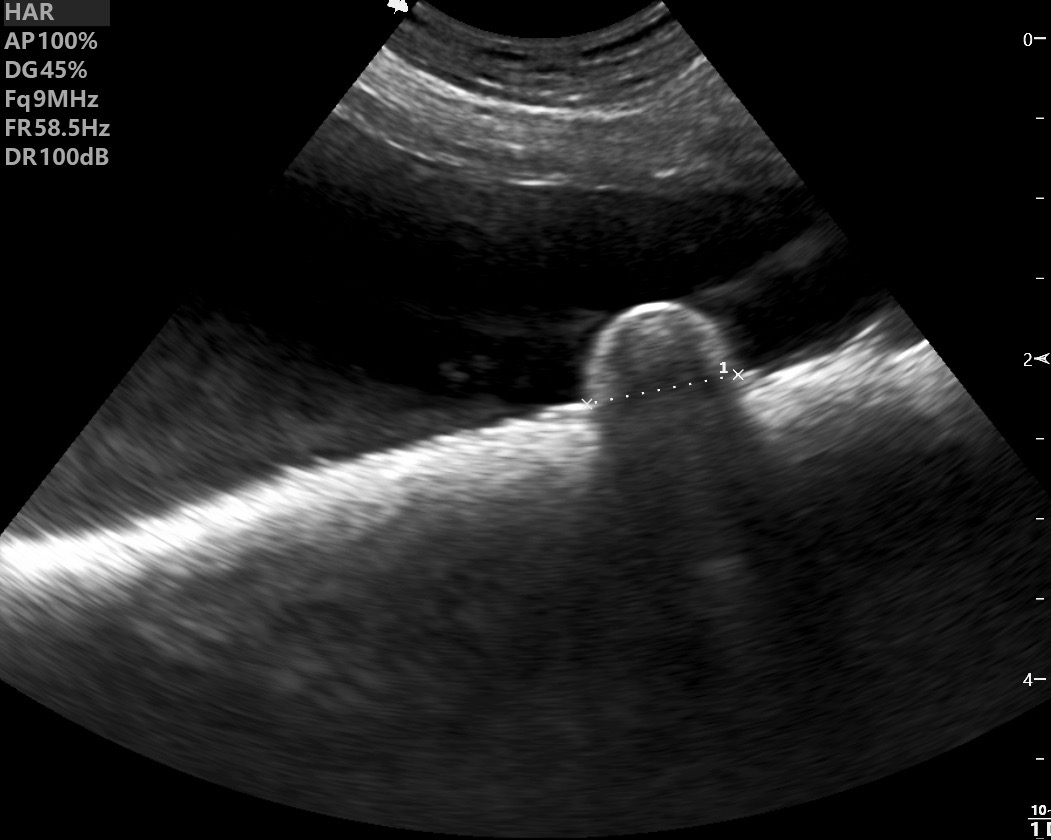
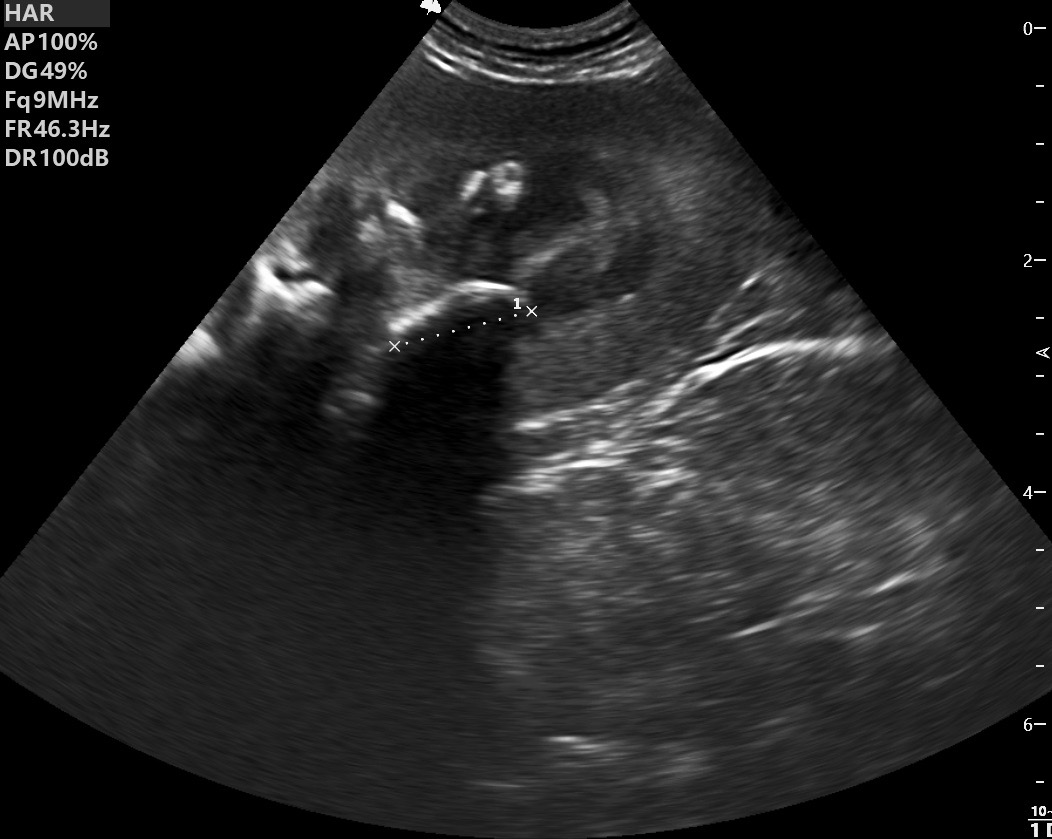
Deux électrophorèses de chiennes leishmaniennes : à gauche, celle d’une beauceronne de 12 ans, avec une sérologie très positive (1/1260) : les protéines totales sont élevées, du fait d’une forte augmentation des globulines béta-2 et gamma, qui forment un « bloc » dans la partie droite le tracé. A droite : Electrophorèse quasiment normale, (qui peut donc nous servir d’image de référence), chez une chienne griffon de 10 ans, ayant pourtant à la fois la leishmaniose et l’ehrlichiose (!), mais bien stabilisée sous traitement. (Laboratoire Vebio ; les concentrations des différentes fractions protéiques (Conc.) et leurs valeurs de référence (Ref. Conc), sont indiquées sous chaque électrophorèse.
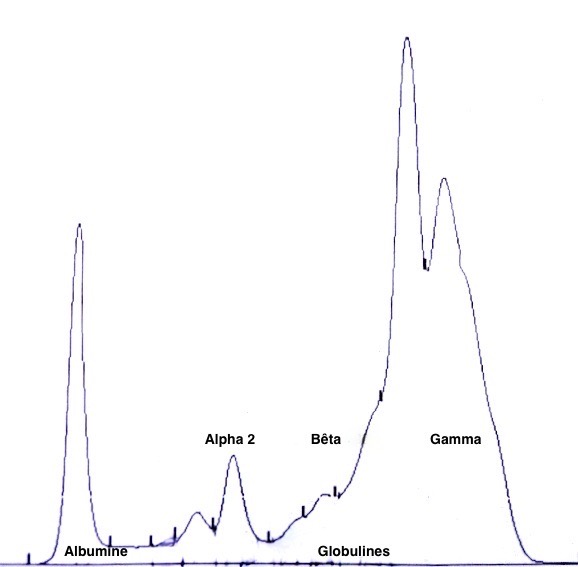
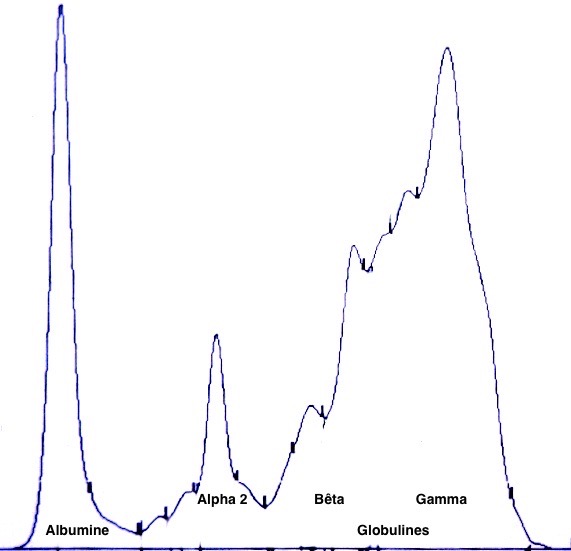
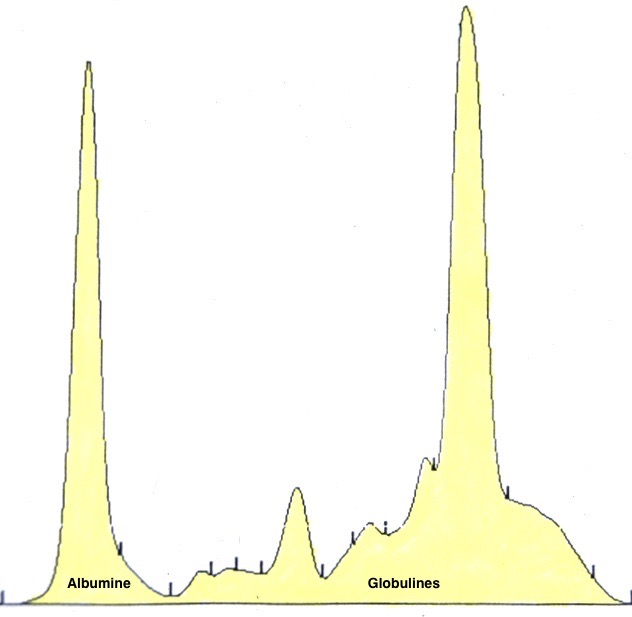
Deux autres électrophorèses très modifiées : le tracé de gauche est celui d’un chien ayant à la fois la leishmaniose et l’ehrlichiose : les taux de protéines totales (102 g/l) et de gamma-globulines (65 g/l, le bloc à droite du tracé) sont très élevés, tandis que l’albumine (le petit pic à gauche du tracé) est effondrée à 14 g/l. A droite : électrophorèse d’un chien n’ayant « que » la leishmaniose : les protéines totales sont élevées (84 g/l), avec également une albumine basse (17 g/l), et des gamma-globulines très augmentées, formant un véritable bloc dans la partie droite du tracé (55 g/l).
Voilà pour l’électrophorèse ; c’était un peu long, mais il fallait bien ça. Les autres modifications biochimiques (élévation des enzymes hépatiques, par exemple), sont inconstantes et non spécifiques. Un mot quand même de l’urée et de la créatinine sanguines : si elles sont augmentées, c’est qu’une insuffisance rénale s’est installée, et à moins qu’il ne s’agisse « que » d’une insuffisance rénale aiguë, transitoire, qui va passer en quelques jours sous perfusion… une insuffisance rénale installée chez un chien leishmanien, ce n’est, malheureusement, jamais bien bon.
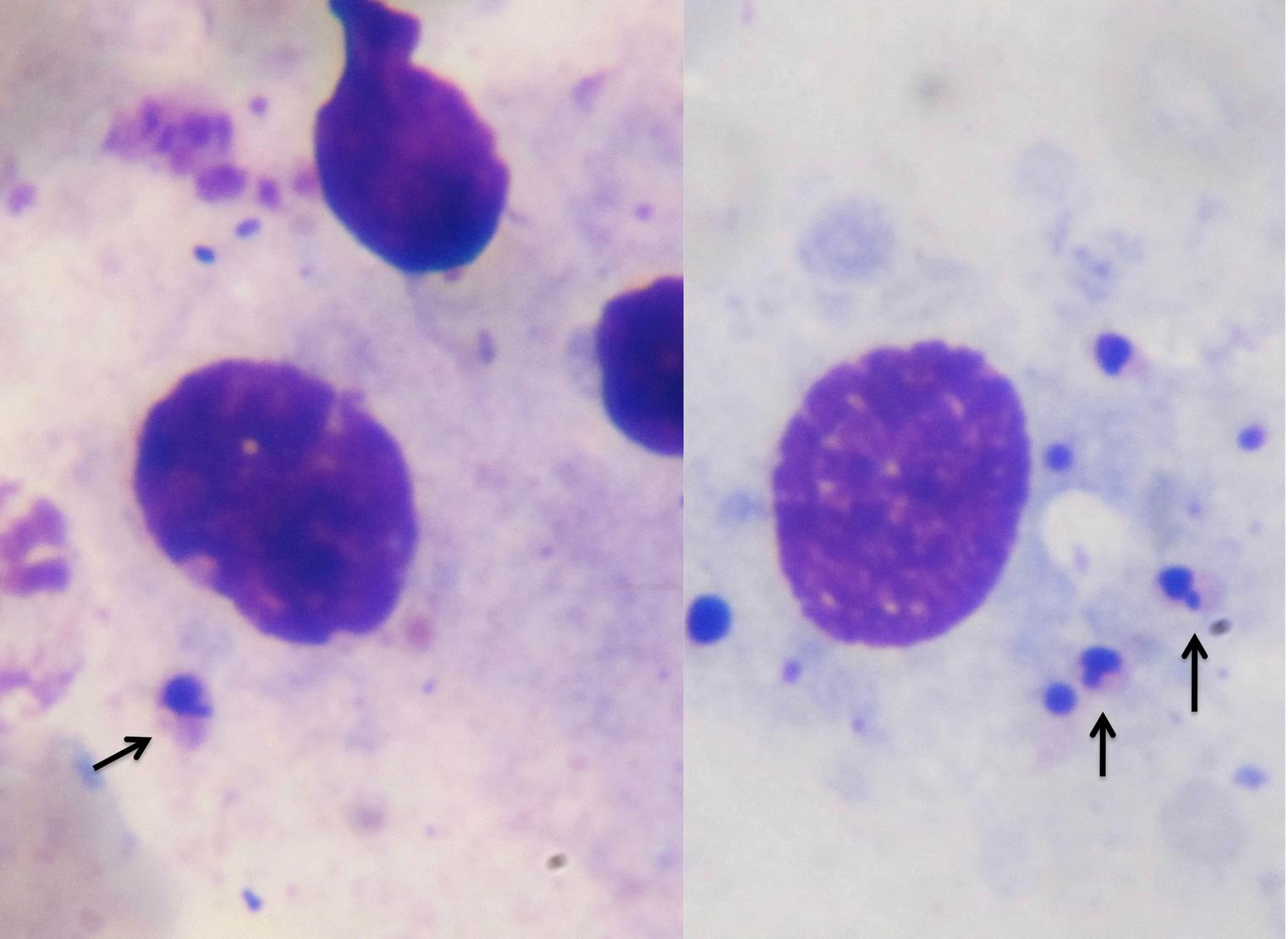
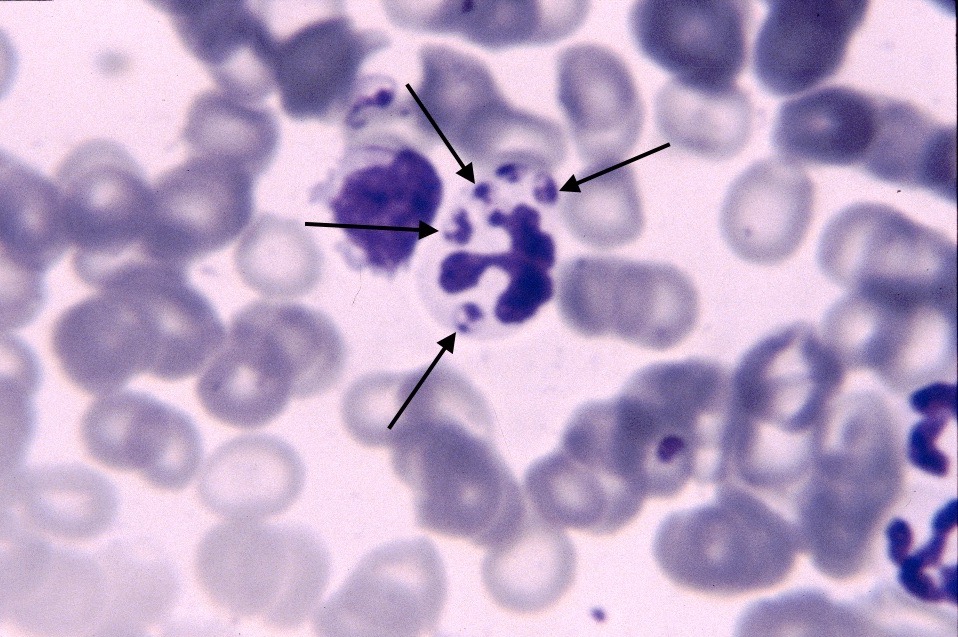
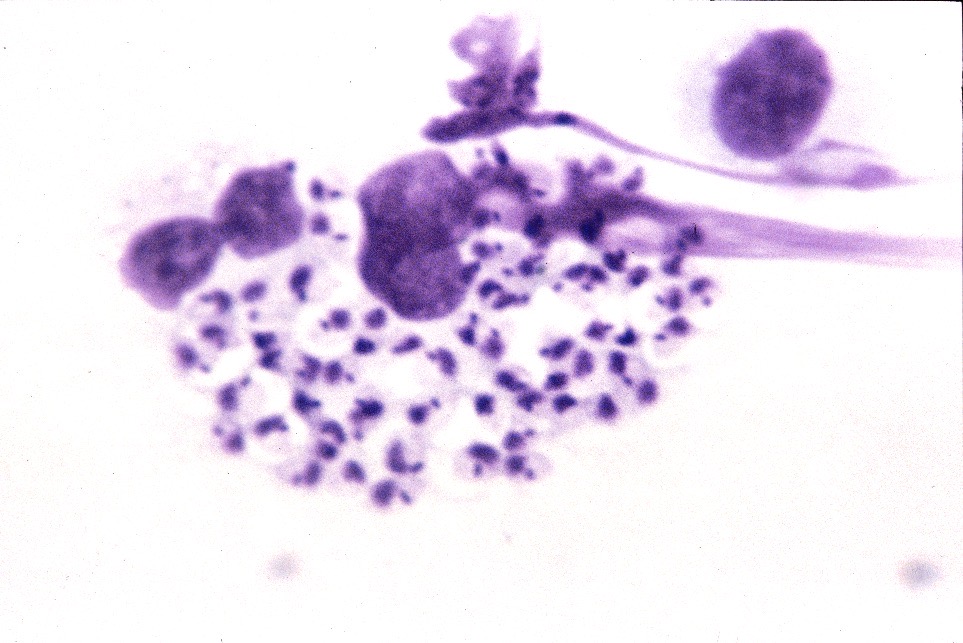
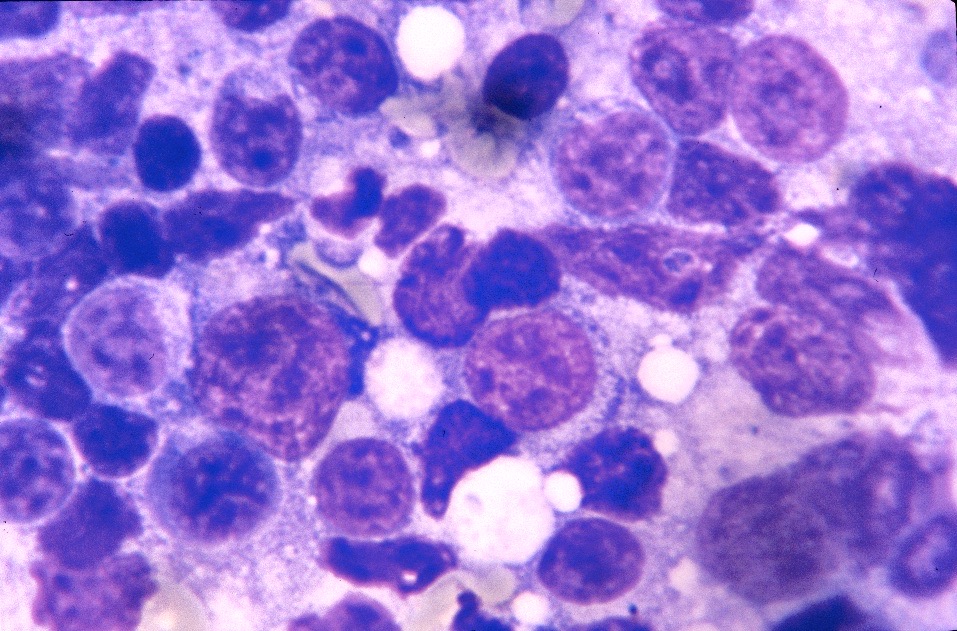
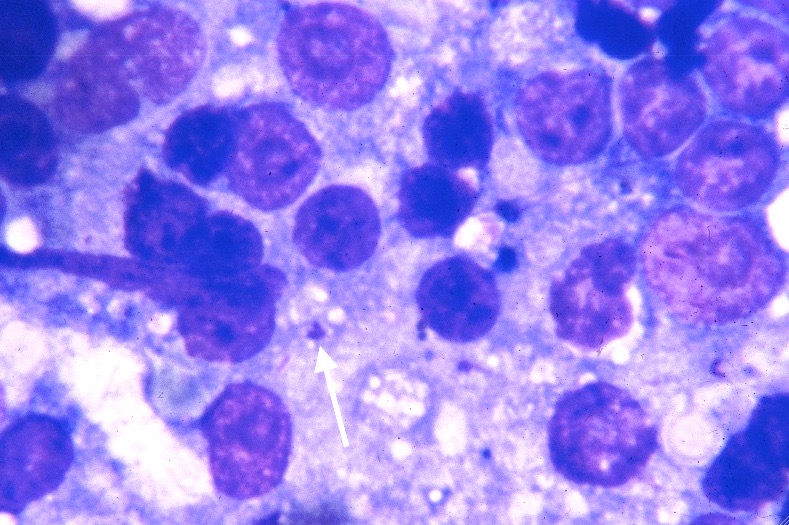
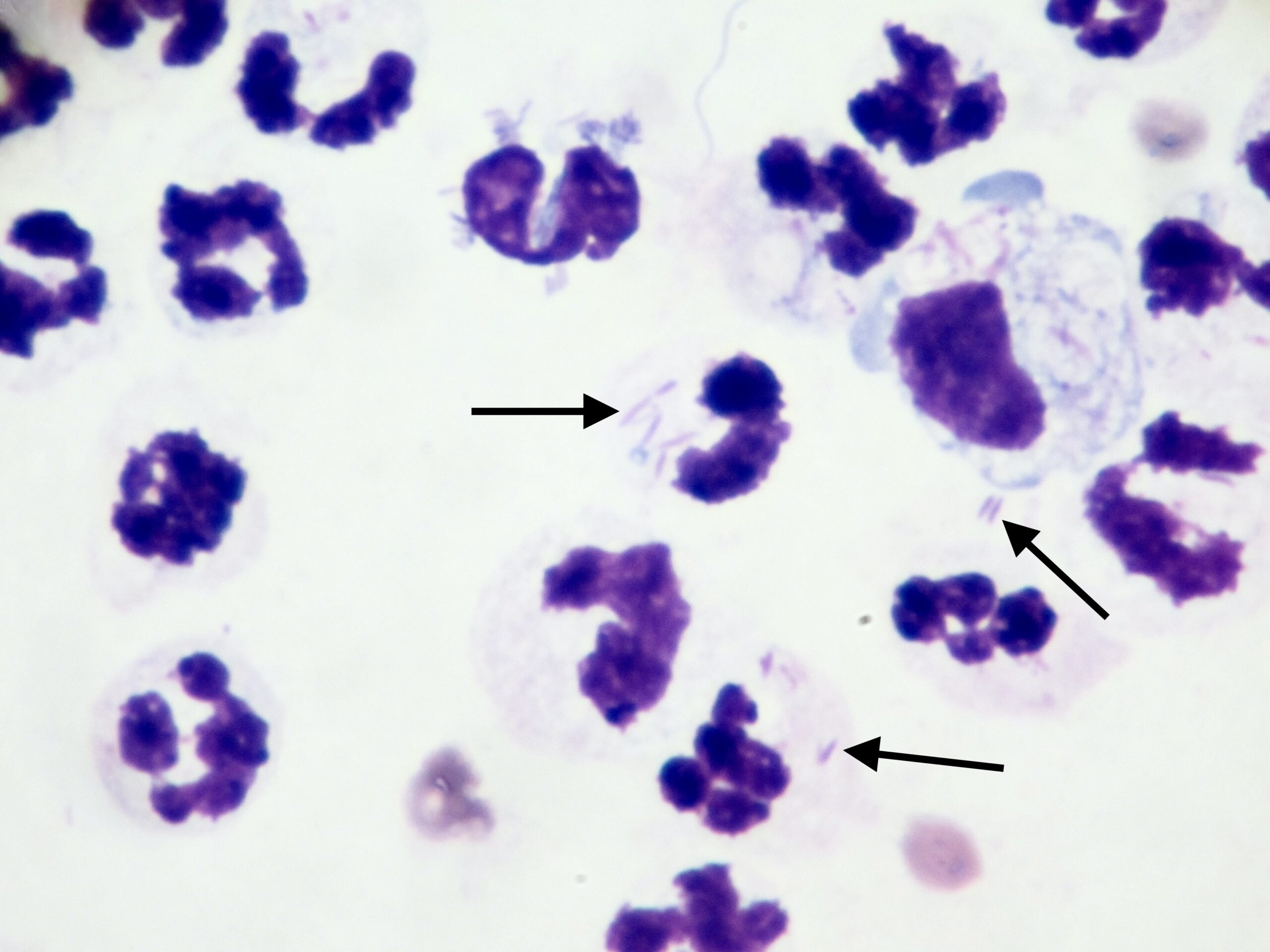
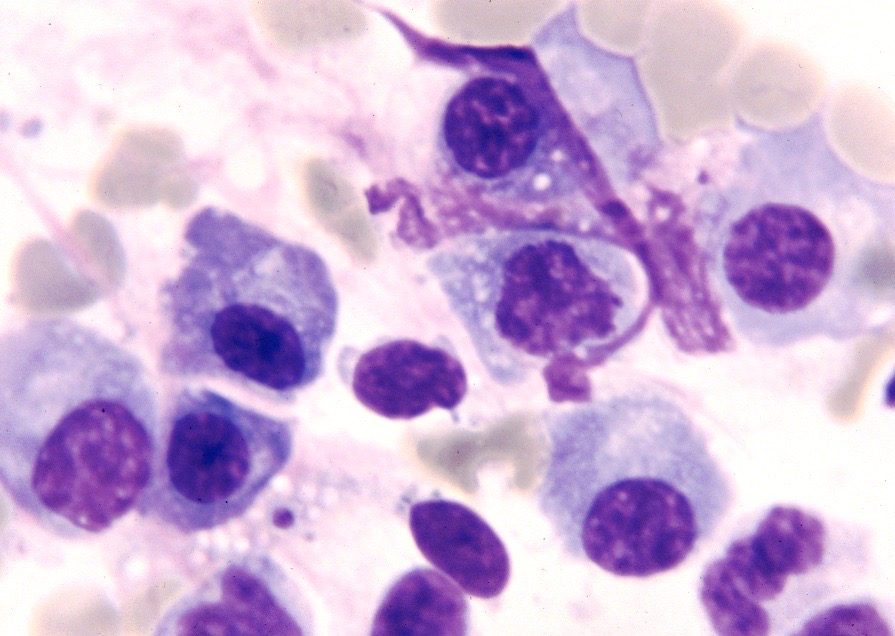
D’un point de vue hématologique, rien de bien spécifique : une anémie, habituellement non régénérative, est présente dans 21% à 94% des cas (c’est large !), selon les auteurs. On en a vu un exemple plus haut, on trouve parfois (pas souvent) des leishmanies directement sur le frottis sanguin. Enfin, du côté de la moelle osseuse, on trouve généralement (mais pas toujours) plein de leishmanies partout, et d’un point de vue cellulaire, des plasmocytes (cellules produisant des anticorps, on y revient !), en quantité augmentée. La lignée rouge peut, au contraire, être diminuée. (Quand une anémie est présente, elle est le plus souvent centrale et d’origine inflammatoire).
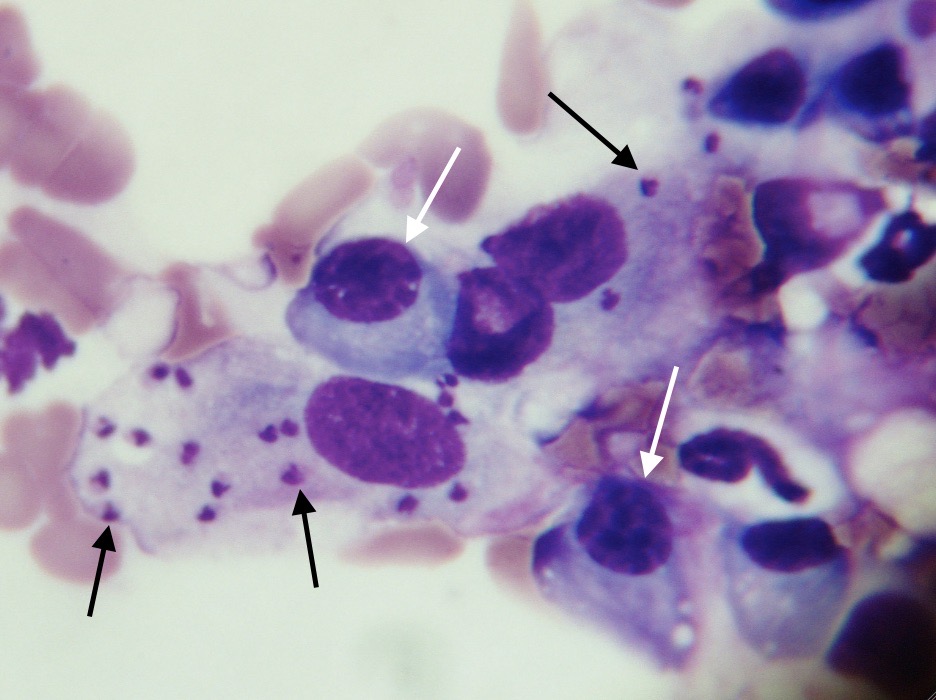
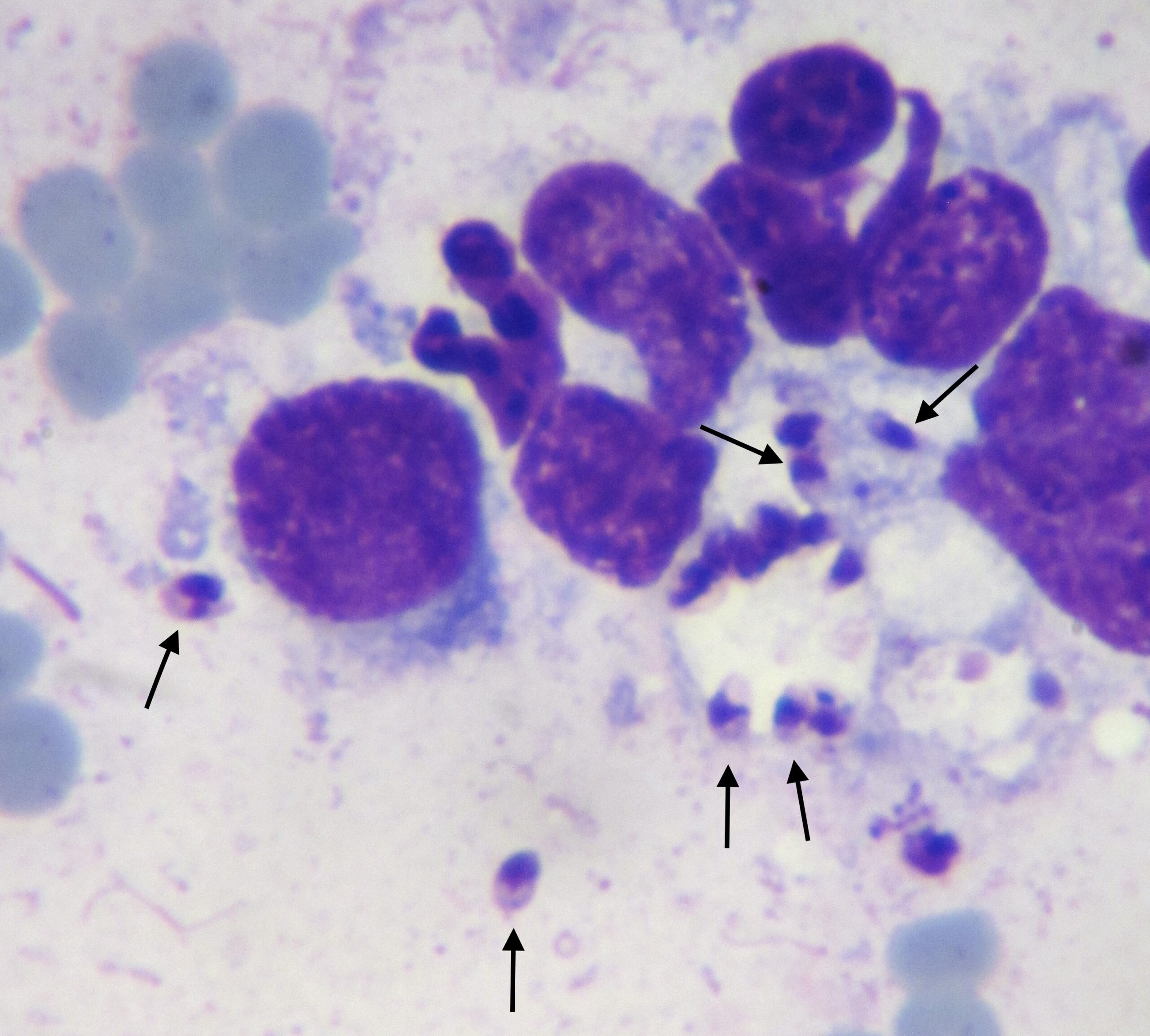
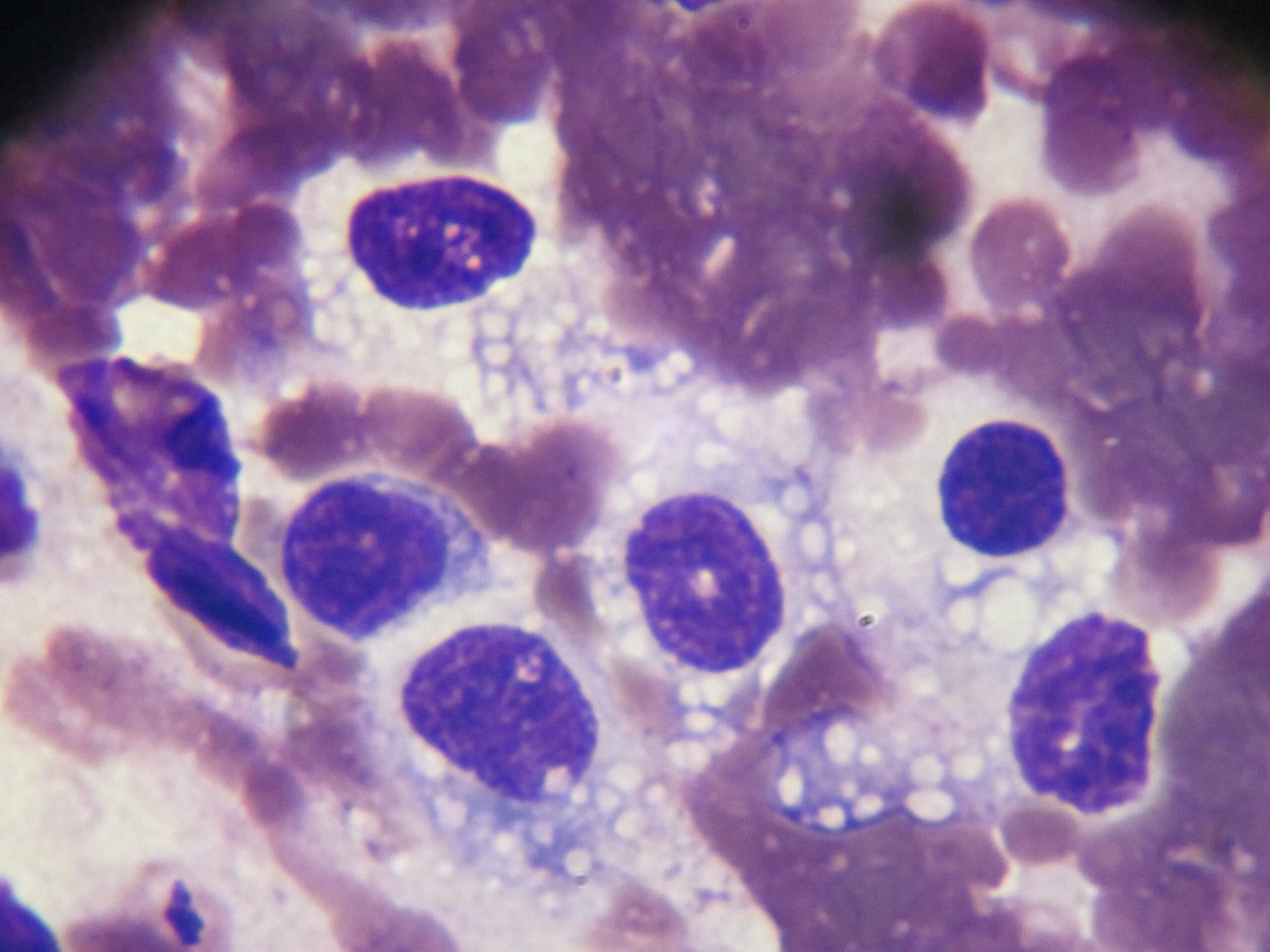
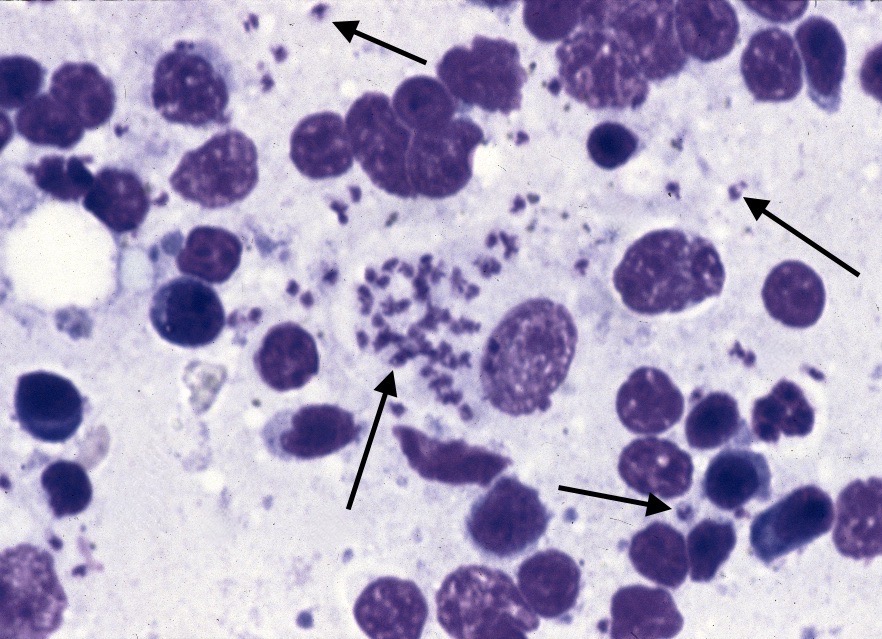
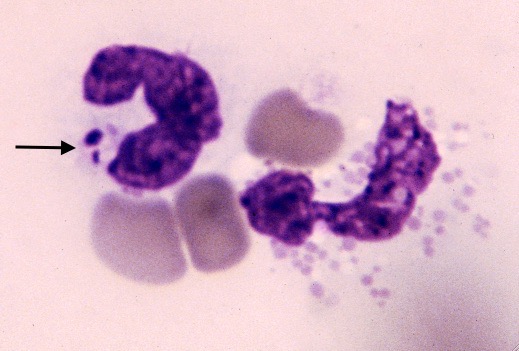
Frottis de moelle osseuse chez un boxer leishmanien : nombreuses leishmanies (flèches noires) à l’intérieur de deux histiocytes sur la photo de gauche, et plusieurs plasmocytes (flèches blanches) sur les deux photos. Aucun érythroblaste (précurseur des globules rouges), n’est visible sur ces deux images.
Terminons ce tour d’horizon des signes biologiques avec l’analyse d’urines, qui révèle la présence d’une protéinurie (= fuite de protéines par les urines), parfois massive, dans 48% des cas selon une étude (davantage selon notre propre expérience). Cette protéinurie est due au dépôt, dans les glomérules du rein, de complexes immuns circulants (produits d’une réaction antigène-anticorps : revoilà nos anticorps inutiles, et maintenant délétères). Comme les glomérules rénaux sont chargés (entre beaucoup d’autres choses) d’empêcher nos protéines, notamment l’albumine, de s’enfuir par les urines, eh bien s’ils sont lésés, ils n’empêchent plus rien et toutes nos protéines s’en vont, ce qui est évidemment bien embêtant. Des biopsies rénales réalisées chez 41 chiens leishmaniens ont montré la présence de lésions glomérulaires dans tous les cas.

Test de Heller, sur les urines du boxer dont nous avons vu la moelle osseuse juste au-dessus. Le test de Heller n’est peut-être plus tellement utilisé aujourd’hui, vu que nous disposons de moyens beaucoup plus sophistiqués pour reconnaître et chiffrer une fuite protéique, avec notamment le rapport protéines/créatinine urinaires (RPCU). Néanmoins, une petite bandelette urinaire ou un test de Heller sont quand même bien utiles pour savoir s’il y a ou non protéinurie, et s’il est nécessaire ou pas d’engager les frais d’un RPCU. En plus, pour mettre en photo sur un site, le test de Heller, c’est quand même beaucoup plus parlant qu’un RPCU sur une feuille de résultats. Donc concrètement, on prend les urines du chien, on y ajoute de l’acide nitrique en essayant de ne pas trop s’en mettre sur les doigts, et s’il y a des protéines dans les urines, on a une sorte de nuage blanc qui apparaît à l’interface entre urines et acide. Ce test est très sensible, il détecte toutes les protéines, et on peut déjà avoir une idée de l’importance de la protéinurie en fonction de l’épaisseur de l’anneau. Et après, on chiffre avec un RPCU. Dans le cas de notre boxer, la protéinurie est malheureusement assez massive !
Diagnostic et maladies intercurrentes
Petite réflexion préliminaire : en matière de leishmaniose, il y a diagnostic et diagnostic. Il convient en effet de distinguer le diagnostic de l’épidémiologiste, du diagnostic du clinicien. Le premier cherche à identifier, dans une population, tous les chiens porteurs de leishmanies, et utilise à cette fin des outils de plus en plus sensibles. On l’a vu plus haut, si l’on prend l’exemple des Cévennes, 30% des chiens étaient déjà positifs avec un test sérologique, ils sont 80% – donc, en fait, quasiment tout le monde ! – maintenant que le dépistage se fait par PCR. Pour le clinicien, la question est différente : ce chien, sur ma table de consultation, présente des symptômes compatibles avec la leishmaniose ; quels sont les moyens à ma disposition pour la diagnostiquer – ou l’exclure ? Cette différence d’approche pose évidemment bien des questions : un chien en bonne santé trouvé positif en PCR lors d’un dépistage parce qu’il héberge quelques leishmanies, doit-il être considéré comme leishmanien et du coup, traité ? Question épineuse que nous ne trancherons pas aujourd’hui, (ni même un autre jour, d’ailleurs), nous contentant d’une approche purement clinique et pragmatique !
Donc, ceci étant posé, quatre moyens sont à notre disposition pour diagnostiquer – ou exclure – une leishmaniose chez le chien assis sur notre table de consultation ; et parfois il faudra en combiner plusieurs. D’abord, les examens clinique et biologiques dont on a déjà abondamment parlé. C’est sûr que quand on est en plein milieu des Cévennes et qu’on voit arriver un chien comme celui dont la photo figure tout en haut de cet article… Ben il n’y a pas trop de doute quant au diagnostic. Cela dit, pas trop de doute, c’est encore un peu trop pour la leishmaniose, vu ce qu’implique un diagnostic positif : un traitement long, le plus souvent à vie, des contrôles réguliers, voire une décision d’euthanasie selon l’état du chien et la volonté des propriétaires. En plus, il y a d’autres maladies dont les symptômes ressemblent comme deux gouttes d’eau à ceux de la leishmaniose, on en verra des exemples. Donc, on ne va pas se contenter de regarder le chien, il va falloir creuser un peu. Et pour ça, on à notre disposition des ponctions (de moelle osseuse, de ganglions…), des sérologies, de la PCR… et on dira un mot du diagnostic différentiel et des maladies intercurrentes. Allez hop, on clique sur les petits boutons juste en-dessous, et c’est parti !

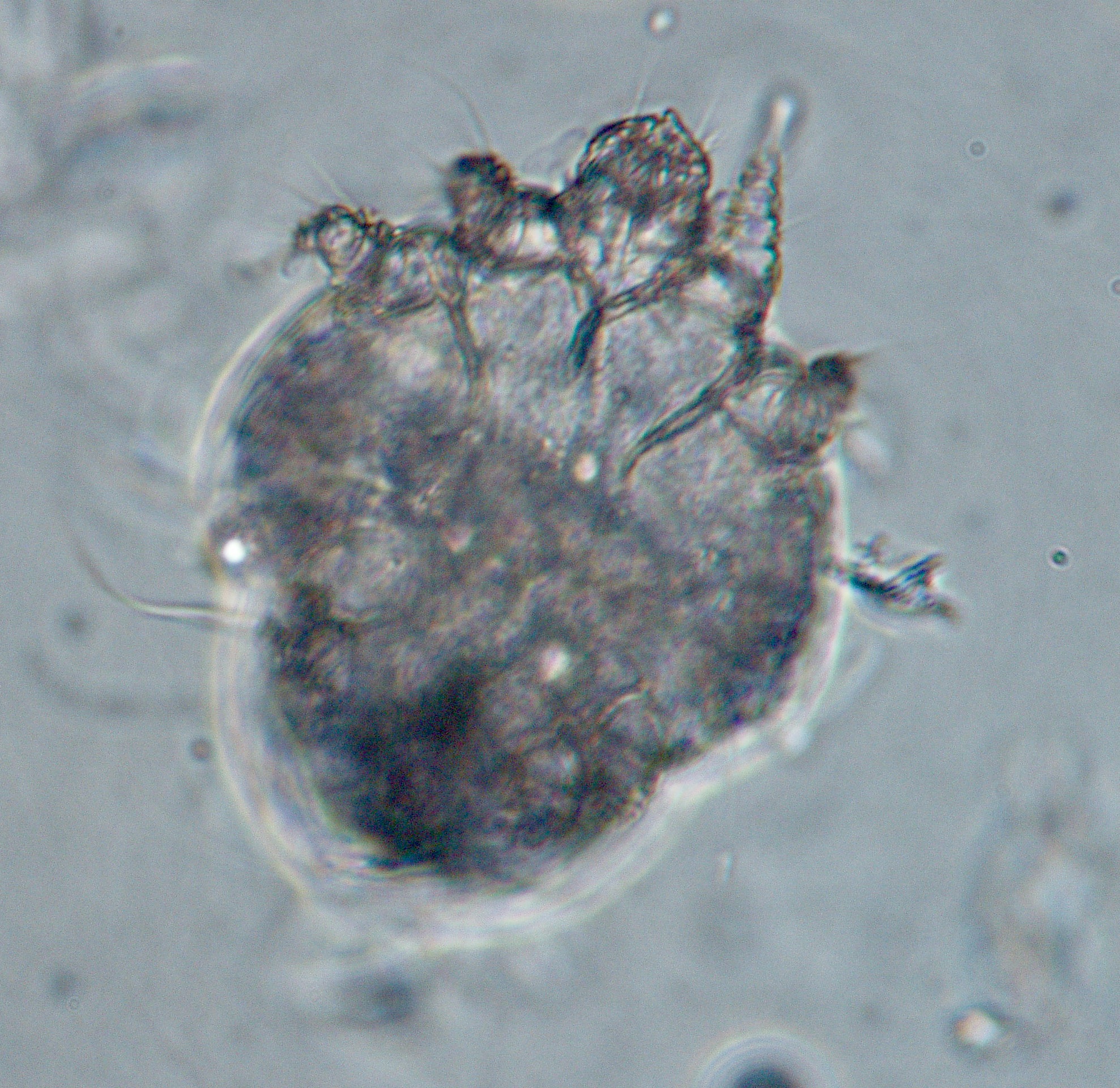
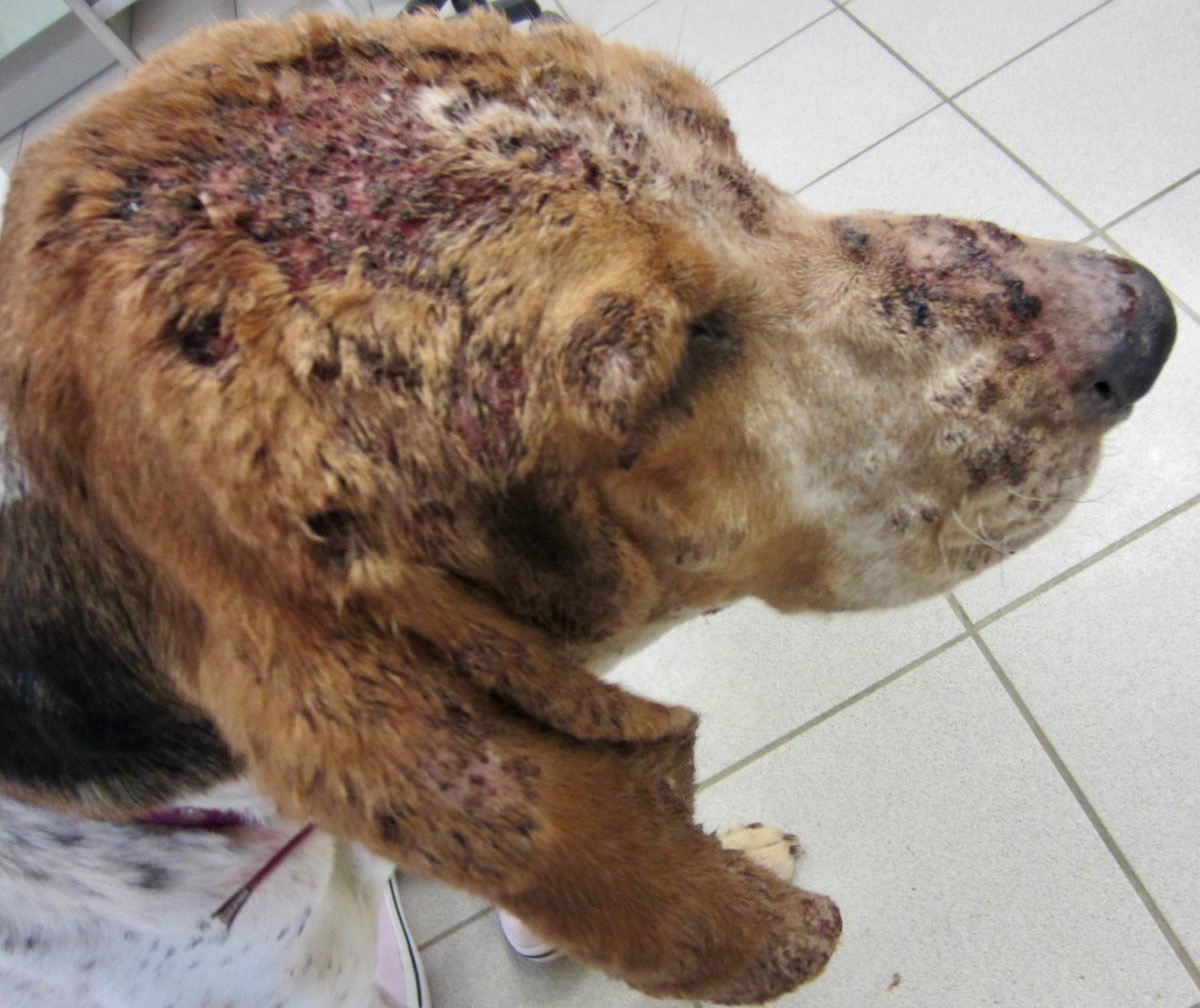
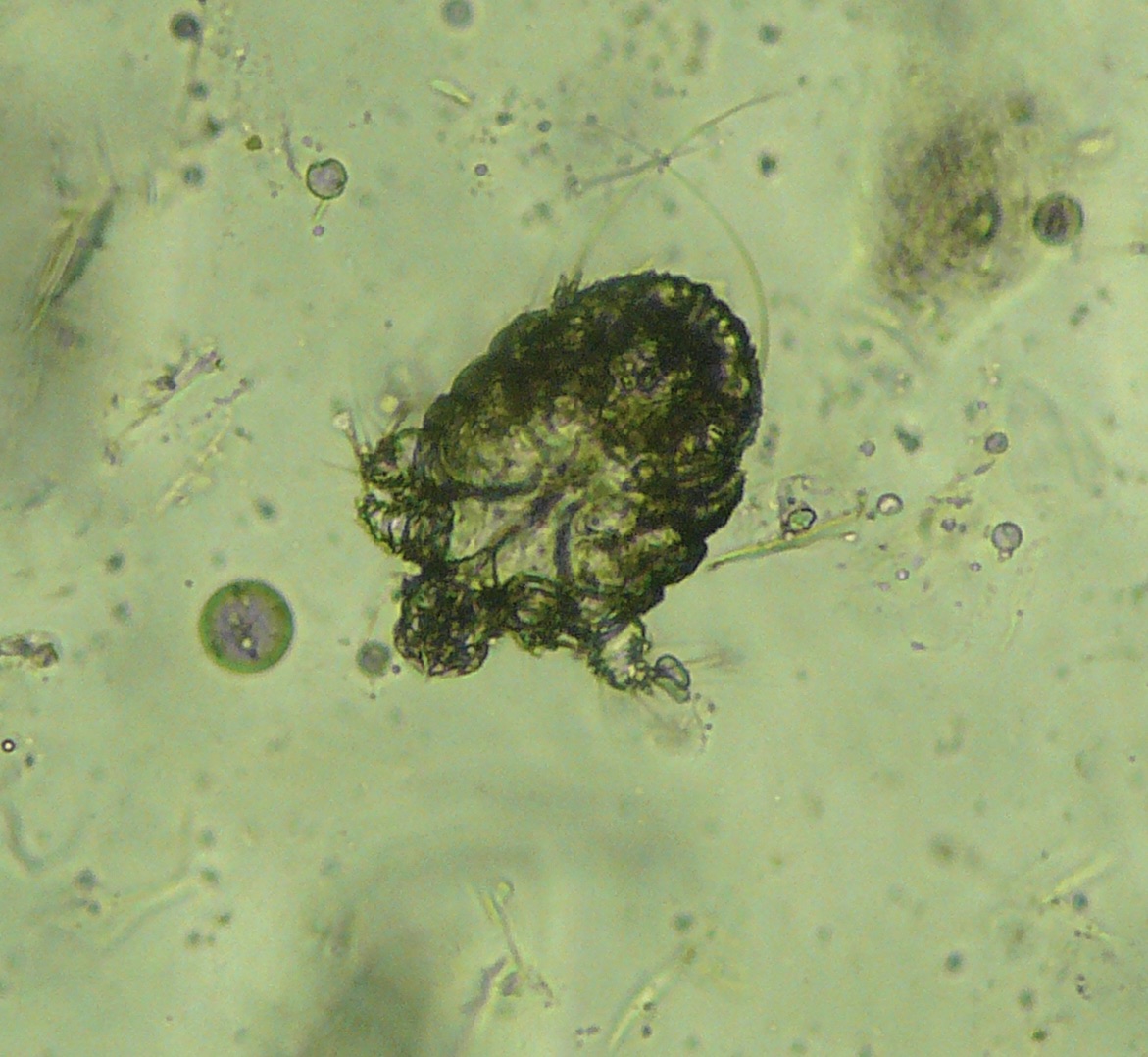
Tiens, pour illustrer ce qu’on vient de dire, en voilà un avec une bonne tête de leishmanien – et pas que la tête, d’ailleurs ! Il avait effectivement la leishmaniose, mais comme il y en a qui n’ont vraiment pas de chance, il avait une gale sarcoptique en plus, cette dernière sans doute responsable des symptômes cutanés au moins autant, voire davantage que la leishmaniose. Donc si on ne va pas au bout du diagnostic, on traite uniquement la leishmaniose, et on se demande pourquoi ce satané chien ne guérit pas ; et ça risque de se finir très mal pour le toutou.
Traitement
Sylka avant / après : mais oui, dans beaucoup de cas, la leishmaniose, ça se soigne ! Tous les détails ci-dessous.
Alors, avant tout, attention : nous allons donner ici quelques éléments sur le traitement de la leishmaniose en général, et sur les différentes molécules utilisées en particulier, mais si jamais vous êtes propriétaires d’un chien leishmanien, les paragraphes suivants ne vous diront pas comment le traiter ! Le choix d’un traitement répond en effet à toutes sortes de considérations, et sera en particulier fonction de l’état du chien : on ne traitera pas de la même façon un chien séropositif sans symptôme, et un autre en très mauvais état général, avec une insuffisance rénale sévère. La réponse du chien au traitement, l’évolution de la maladie, devront aussi être prises en compte. C’est donc tout à fait volontairement que nous ne décrirons pas ici des protocoles standards avec la dose des médicaments, la fréquence des prises, etc : tout cela est à voir au cas par cas, avec le vétérinaire du toutou.
Ceci étant dit, plusieurs molécules sont utilisées pour traiter la leishmaniose canine. Il s’agit essentiellement de l’antimoniate de N-méthylglucamine (GLUCANTIME ®), de l’allopurinol (seul ou en association avec le GLUCANTIME), et de la miltéfosine. D’autres médicaments sont utilisés, dont nous dirons un mot, mais qui ne font pas l’objet du même consensus. Ces molécules permettent le plus souvent, (malheureusement, pas toujours !), une bonne amélioration clinique, mais rarement une guérison complète : une rechute est habituelle dans les six à douze mois, si l’on arrête tout traitement sans précaution. Ceci s’explique sans doute par la mauvaise réponse immunitaire des chiens malades (cf plus haut, la partie sur la pathogénie), et par la difficulté d’atteindre des concentrations thérapeutiques efficaces à l’intérieur des macrophages, et dans des parties de l’organisme mal vascularisées (peau, tissus kératinisés, corps vitré…)
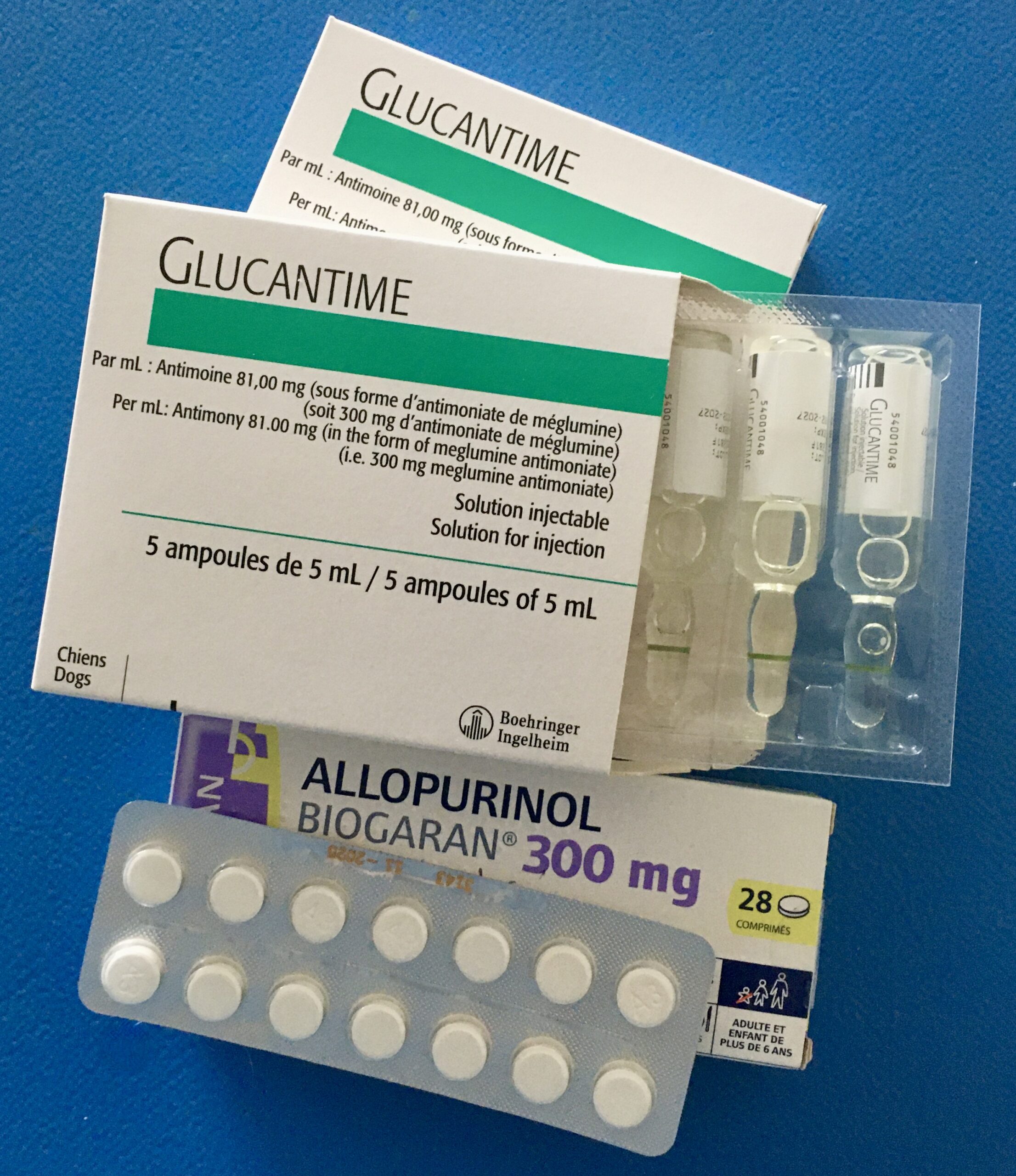
Il nous arrive tout de même de pouvoir arrêter complètement le traitement, chez des chiens trouvés négatifs en sérologie lors de deux ou trois contrôles consécutifs, à quelques mois d’intervalle. Le traitement est alors arrêté, avec à nouveau plusieurs contrôles sérologiques à quelques mois d’intervalle. Si les chiens restent négatifs, on se contente alors d’un contrôle sérologique annuel. Si la sérologie redevient positive, le traitement est repris. En cas de doute, d’autres analyses peuvent aider à savoir où en est la leishmaniose, donc à prendre la décision d’arrêter, de poursuivre ou de reprendre le traitement : l’électrophorèse des protéines sanguines, la numération formule, l’urée et la créatinine pour évaluer la fonction rénale… En suivant ce protocole (tout à fait personnel, il ne fait pas l’objet d’un consensus !), il nous arrive de pouvoir arrêter tout traitement chez quelques chiens, mais ce n’est pas la majorité.
Allez, vous commencez à avoir l’habitude : quelques petits boutons, sur lesquels cliquer pour voir les principales molécules utilisées, leurs avantages… et leurs inconvénients.
Prévention
Méthode de prévention radicale, l’élimination des chiens (plus ou moins) symptomatiques a été pratiquée en Chine et dans certaines républiques d’Asie centrale de l’ex-URSS – deux états qui ne se caractérisaient pas par leur sens de la mesure. En Chine, en particulier, l’abattage des chiens a fait partie d’un vaste plan dont les deux autres volets étaient un traitement de masse des patients humains, et l’élimination des phlébotomes par épandage de DDT. Tout cela n’a, ma foi, pas si mal fonctionné dans un premier temps, la leishmaniose humaine étant devenue assez rare en Chine dans les années 1970… mais quelle est la part de l’abattage des chiens, par rapport au traitement des humains et à la destruction des phlébotomes ? De nouveaux foyers de leishmaniose (humaine) sont d’ailleurs réapparus quelques années plus tard, montrant que la maladie n’avait pas été éradiquée. Inutile de dire que les chiens n’ont pas été abattus selon des critères bien précis : tous ceux qui avaient le malheur de se trouver en zone d’endémie y sont passés.
L’abattage des chiens séropositifs a aussi été longtemps pratiqué au Brésil, sans trop de succès semble-t-il : malgré un nombre incalculable de chiens abattus depuis plusieurs décennies, ce pays reste l’un des six responsables de 90% des cas de leishmaniose humaine dans le monde, et le nombre de cas humains n’a fait qu’augmenter entre les années 1990 et 2010. Malgré ce, et malgré l’opposition d’une grande partie de la population pour des raisons éthiques évidentes, les autorités de santé publique persistent à promouvoir cette mesure.
Bon, il est évident que tout cela ne peut pas marcher. D’abord parce qu’on l’a vu, la sérologie ne détecte pas tous les chiens infectés : il faudrait faire des PCR et là, on pourrait trouver jusqu’à 90% de chiens infectés dans certains foyers. Donc à moins d’exterminer tout le monde à la chinoise, et encore, ce n’est pas comme ça qu’on éradiquera la leishmaniose. Ensuite, d’autres animaux peuvent servir de réservoir pour les leishmanies – même si, on l’a vu, le chien reste le principal réservoir. Et enfin, la nature (et les humains !) ayant horreur du vide, les chiens abattus seront rapidement remplacés par d’autres, plus jeunes et nouveaux dans les foyers de leishmaniose, donc encore plus sensibles à l’infection.
Et on ajoutera que chez nous, la simple évocation du début d’un semblant de prémisse de projet que peut-être éventuellement on pourrait envisager de mettre en place de ce genre de mesure se heurterait à… certaines résistances !
Donc, on oublie l’abattage, pour nous concentrer sur des méthodes de prévention éthiques et… qui fonctionnent ! En l’occurrence les vaccins (ou plutôt le vaccin, puisqu’actuellement, il n’y en a qu’un seul disponible), les répulsifs pour éloigner les phlébotomes, la chimioprévention et pour terminer, quelques mesures de bon sens, mais… pas forcément faciles à appliquer ! Allez, vous commencez à avoir l’habitude, on clique sur les boutons ci-dessous, et c’est parti !
Et le chat, dans tout ça ?
Comme le chien et d’autres espèces vivant en zone d’endémie, le chat peut être infecté par Leishmania infantum. La transmission est également assurée par les phlébotomes, qui non seulement piquent les chats, mais peuvent également s’infecter sur des chats eux-mêmes infectés.
Du coup, le chat constitue-t-il un réservoir de leishmanies, au même titre que le chien ? Des études sérologiques ont montré une prévalence de l’infection équivalente, voire supérieure chez le chat, par rapport au chien. Ainsi, une étude réalisée dans la région de Nice a montré une séroprévalence de 12% chez le chat vs 12,4% chez le chien. Dans un refuge en Israël, (parmi des chats, il est vrai, en mauvais état), la séroprévalence était même de 75% chez les chats vs 37% chez les chiens, avec des titres sérologiques significativement supérieurs chez les chats ! MAIS en réalisant des PCR sur sang, 25% des chiens et 16% seulement des chats (ce qui est encore pas mal) étaient positifs et plus important encore, la charge moyenne en leishmanies dans le sang des chiens (42 967 parasites/ml, avec une fourchette allant de 305 à 219 975), était très significativement supérieure à celle trouvée dans le sang des chats (1 259 parasites/ml, 470–1 975). Donc, même si l’on peut se dire que le chat, avec sa séroprévalence parfois égale, voire supérieure à celle des chiens, et ses leishmanies en goguette dans le sang, peut constituer un réservoir, sa faible charge de leishmanies détectée par PCR fait que ce rôle ne doit pas être si important que ça, en tout cas bien moindre que celui du chien.
Chat infecté ne veut pas dire chat malade. Au cours des 25 dernières années, seulement une centaine de cas de leishmaniose féline ont été rapportés en Europe, essentiellement en Italie, Espagne, France et Portugal. A titre de comparaison, c’est le nombre de chiens leishmaniens que nous trouvions en deux ans dans les années 1990, dans notre seule patientèle du Gard. Dans la moitié des cas décrits, le système immunitaire des chats leishmaniens était probablement déprimé par un traitement immunosuppresseur, ou par la présence concomitante d’une infection par le FeLV ou le FIV, ou d’une maladie débilitante.
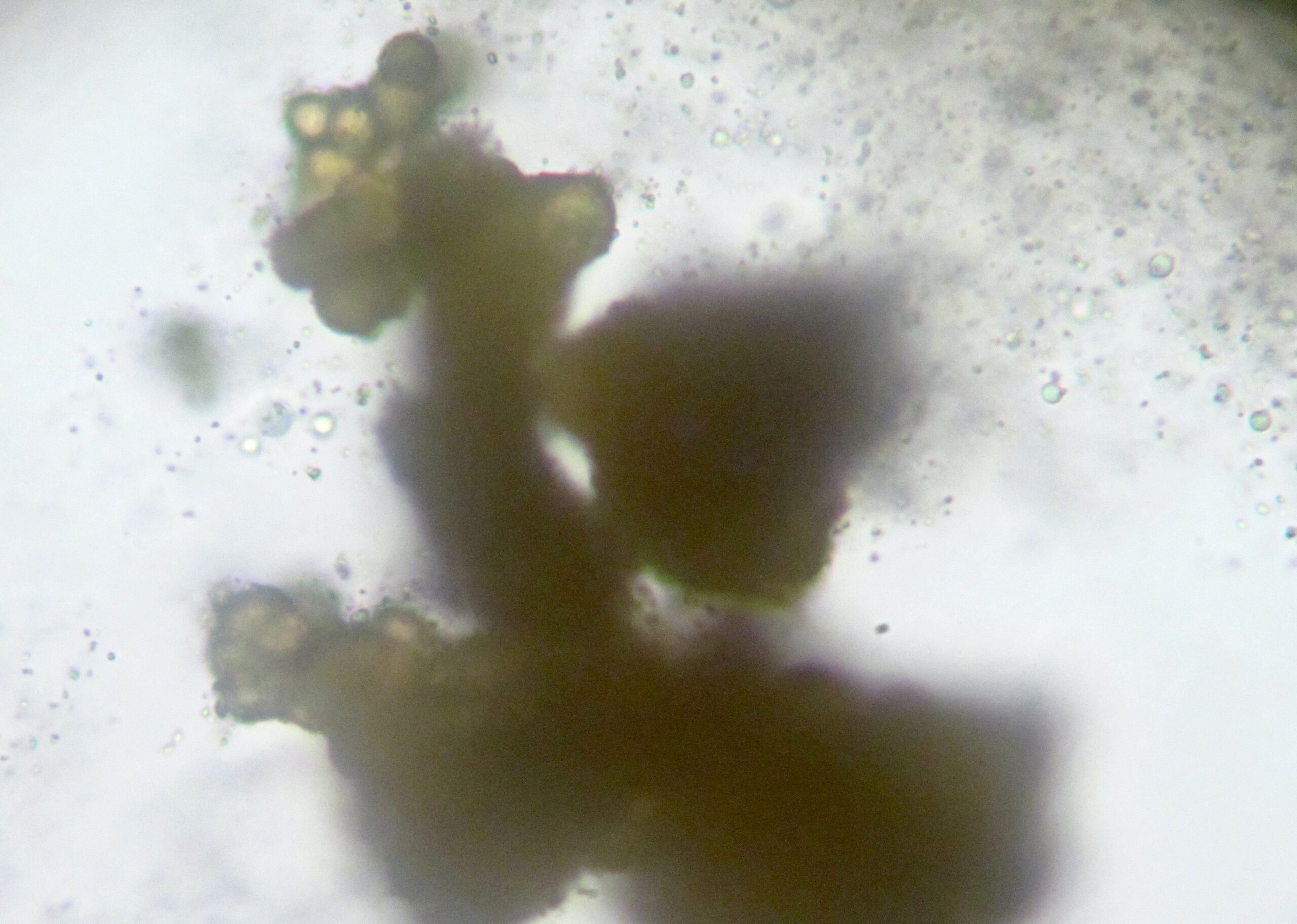
La seule fois que nous avons trouvé des leishmanies chez un chat en 40 ans ! Bon, on en a peut-être laissé passer quelques-unes, mais sans doute pas des dizaines. Ici, il s’agissait d’une petite chatte de 10 ans, référée pour une épistaxis (= saignement de nez) abondante, par la narine droite uniquement. La chatte était anémiée (Hématocrite = 11%). Une rhinoscopie a mis en évidence une lésion proliférative de petite taille, en profondeur dans le sinus droit. Des biopsies de la lésion ont été envoyées dans un laboratoire d’histologie, mais les calques réalisés sur place nous ont permis de découvrir… de nombreuses leishmanies ! (Photos ci-dessus). Malheureusement pour la petite chatte, les leishmanies n’étaient probablement arrivées là qu’en profitant d’une immunité déprimée : la sérologie pour le virus de l’immunodéficience féline (FIV) était positive, et le diagnostic histologique pour la masse dans la narine a été lymphome d’immunophénotype B diffus, à grandes cellules. Donc, présence de leishmanies, mais avec un rôle probablement secondaire, voire inexistant, dans les symptômes de la minette.
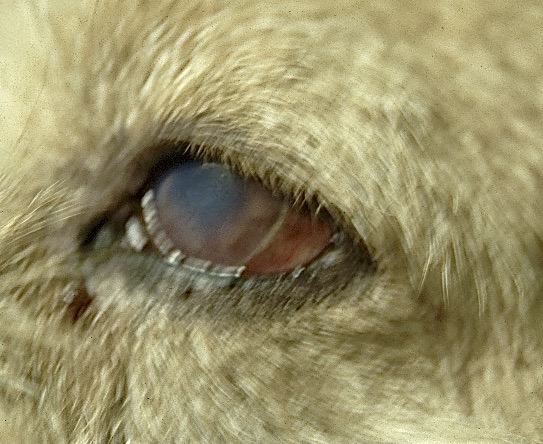
Les symptômes, chez les chats, sont assez semblables à ceux rencontrés chez le chien : en premier lieu, des lésions cutanéo-muqueuses généralement symétriques, notamment sur la face : oreilles, paupières, nez, lèvres ; on y observe des dépilations (sur les oreilles), des croûtes, des nodules, des ulcères… On peut retrouver de telles lésions aux extrémités des membres. Une hypertrophie des ganglions est également fréquente. Les symptômes généraux (abattement, anorexie, amaigrissement, pâleur des muqueuses), oculaires (uvéites) et buccaux (nodules sous la langue ou sur les gncives, stomatite chronique), sont plus occasionnels. Fièvre, ictère, vomissements-diarrhées, jetage nasal et quelques autres sont franchement rares. Côté laboratoire, on décrit classiquement une hypergammaglobulinémie (ci-dessous à gauche) et une protéinurie, comme chez le chien. Une anémie non régénérative et une atteinte rénale sont plus rares.
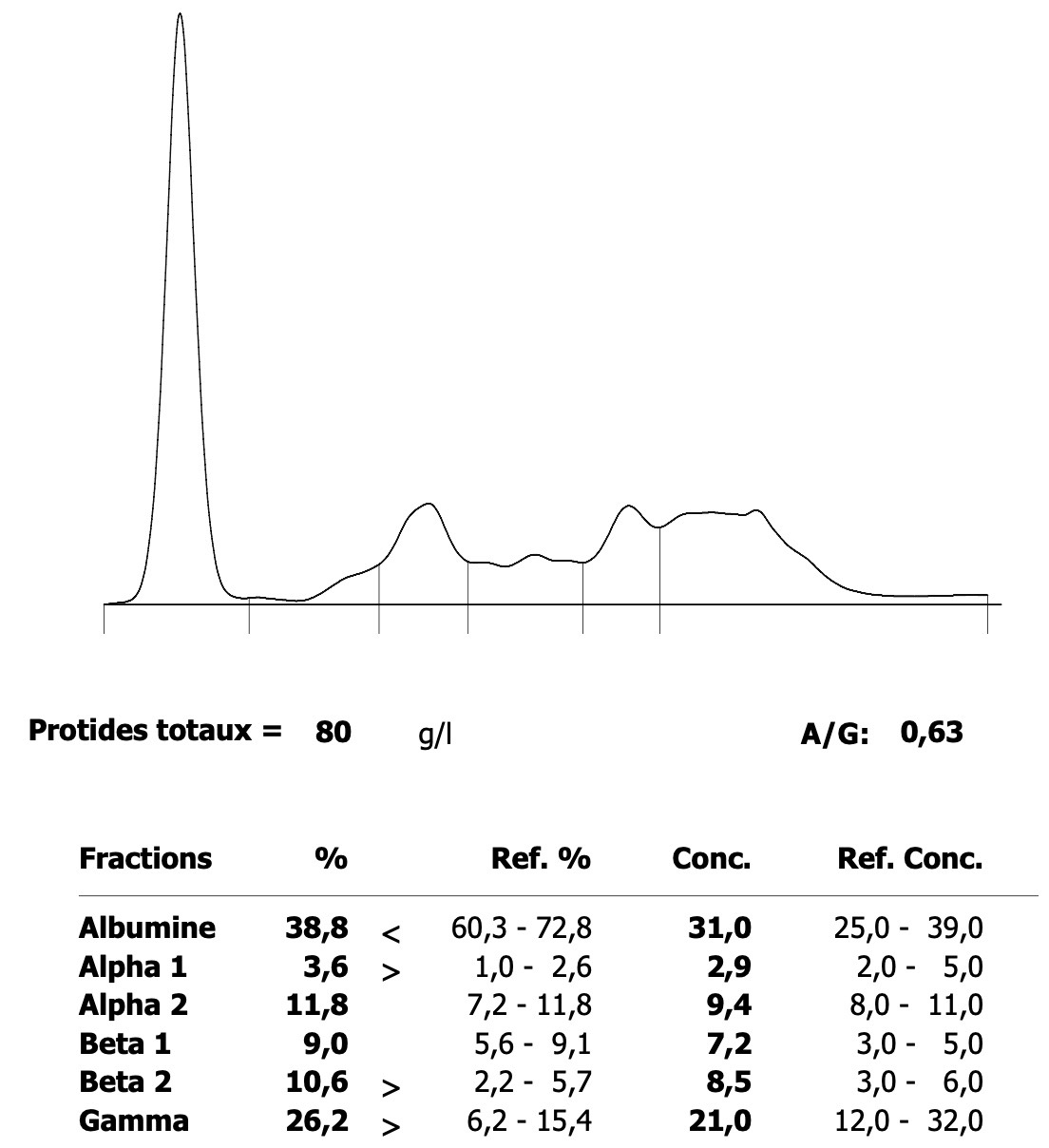
Electrophorèse des protéines de la chatte à lymphome nasal, dont les photos de leishmanies figurent ci-dessus : elle montre une augmentation modérée des globulines, en pic en bêta et polyclonale en gamma, en relation avec la leishmaniose… et/ou le lymphome !
La sérologie leishmaniose (IFI) était fortement positive (1/640).
Une PCR sur sang a également été positive, avec « présence d’une charge élevée de leishmanies dans le prélèvement analysé »
Une sérologie ehrlichiose et des PCR sur sang pour ehrlichiose et anaplasmose sont revenues négatives.
Le diagnostic peut se faire par mise en évidence des leishmanies sur le calque d’une lésion, cutanée ou autre, ou sur une ponction de ganglion ou de moelle osseuse : là, pas de doute, on sait qu’elles sont là ! Le plus souvent, c’est quand même par sérologie (sur une prise de sang) que l’on fait le diagnostic, mais on peut aussi demander une PCR qui nous renseignera sur la présence effective des leishmanies dans le sang, les ganglions, la moelle osseuse, les lésions cutanées…
Concernant le traitement, pas d’étude contrôlée, pas de consensus : on fait à vue de nez, en extrapolant au chat ce qui se fait chez le chien, et apparemment, ça marche pas mal et c’est plutôt bien supporté. Donc allopurinol (surtout), GLUCANTIME® (moins souvent et quand les reins sont d’accord), et éventuellement les deux.