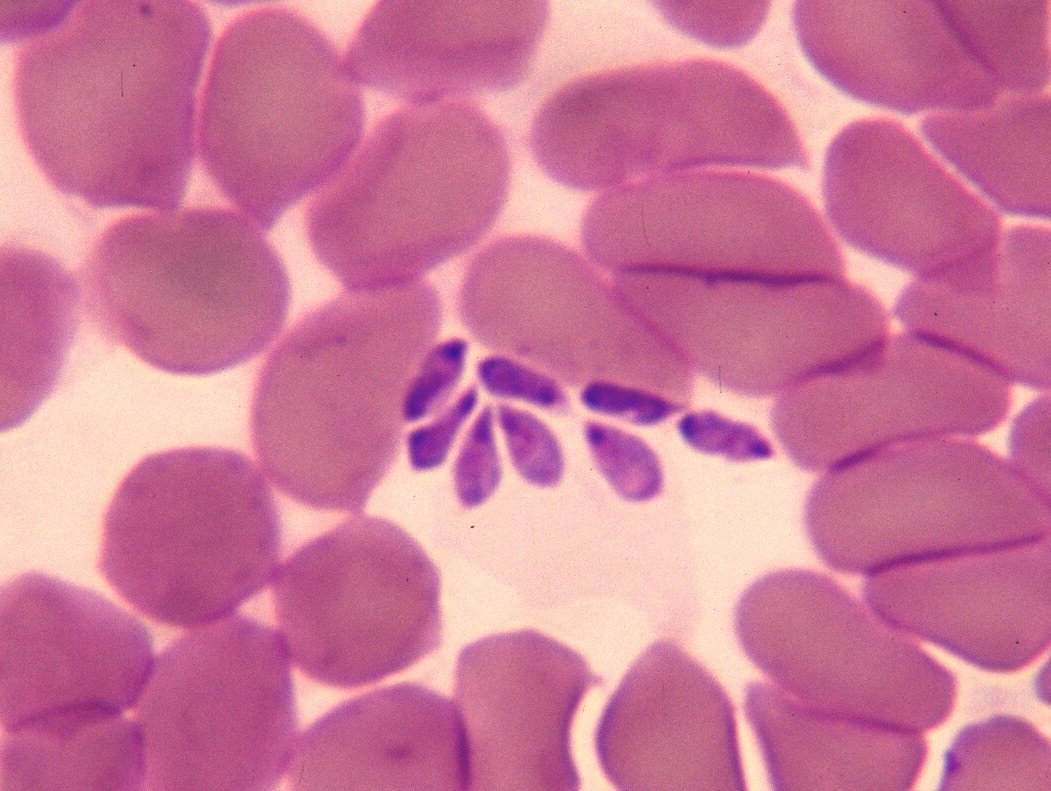
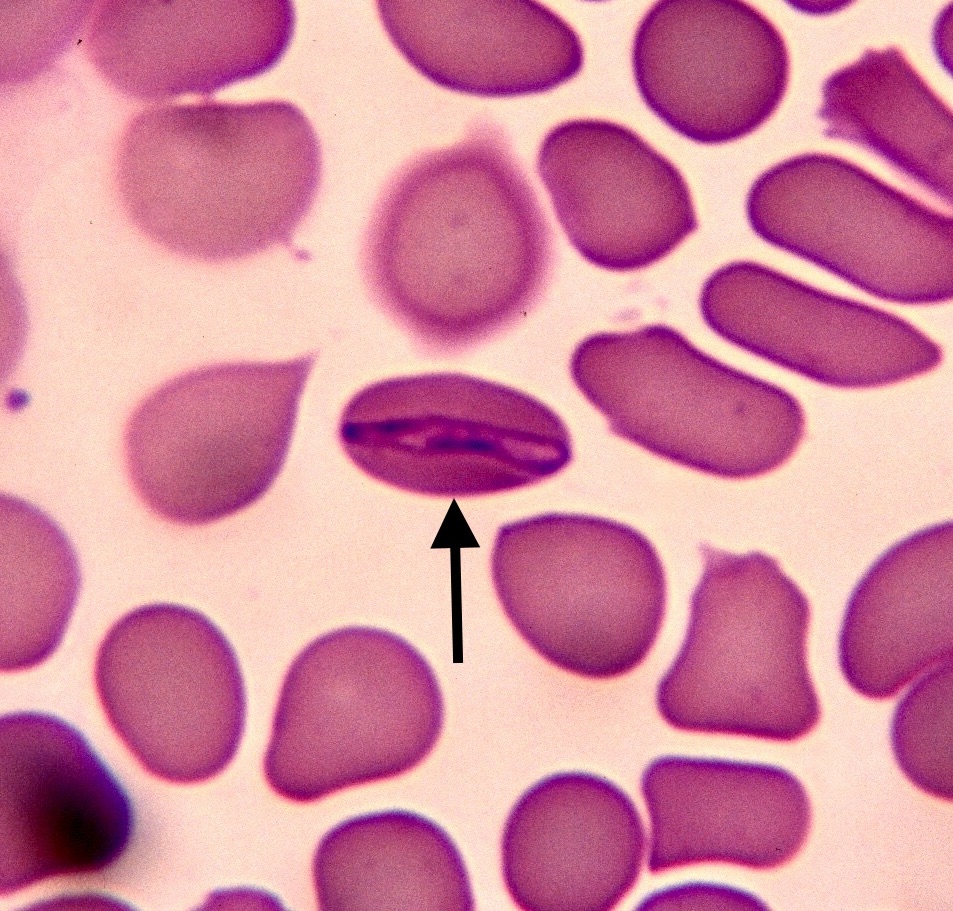
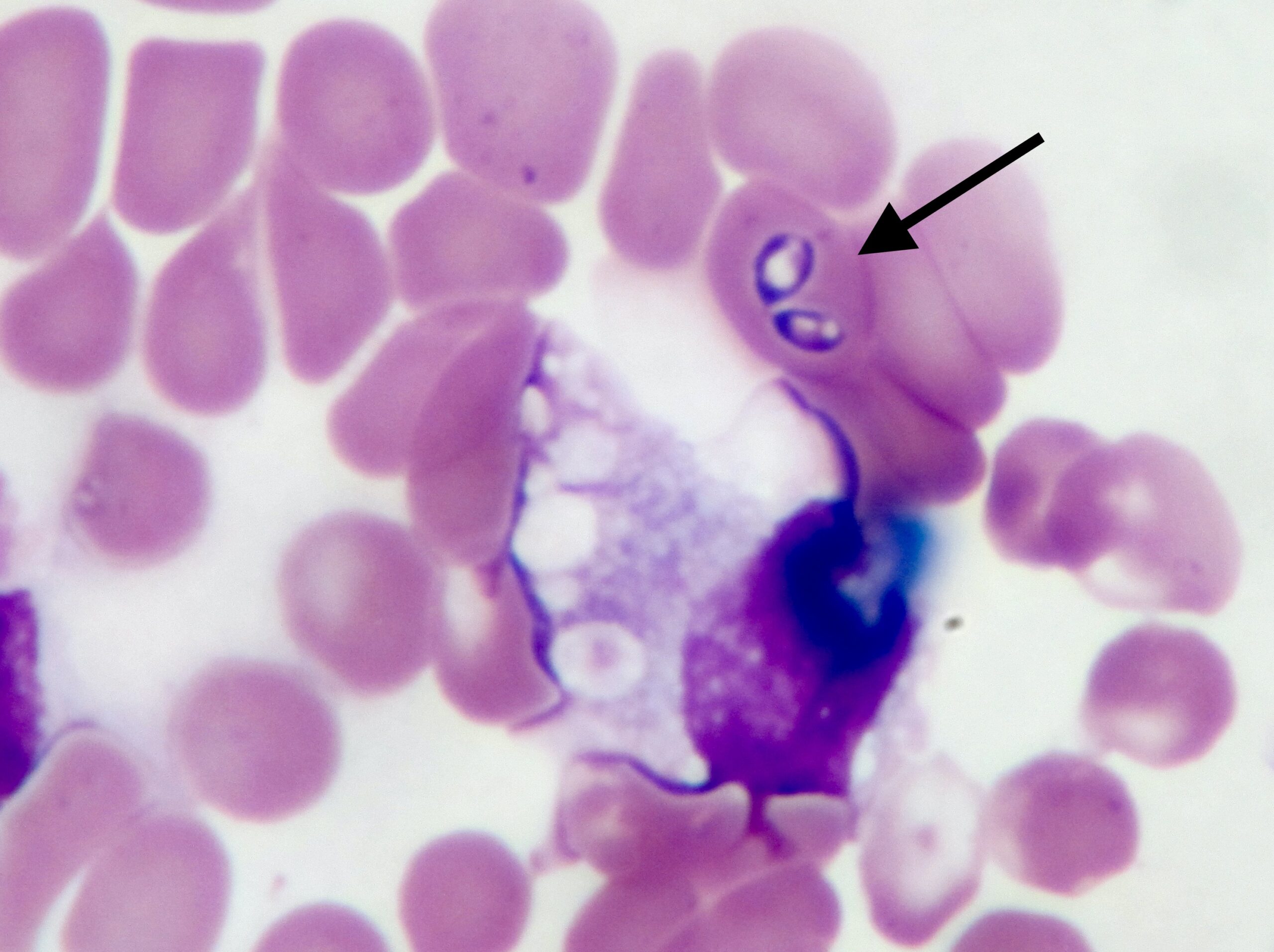
Aspect du frottis sanguin d’un chien atteint de piroplasmose : six piroplasmes sont visibles dans les deux globules rouges en haut à droite de la photo. On notera aussi les différences de couleurs entre les globules rouges. Toutes les explications dans l’article !
De toutes les maladies transmises par les tiques chez le chien, la plus connue est sans doute la piroplasmose, également appelée babésiose. Mais pourquoi ces deux appellations ? A priori, Babesia évoque plutôt une nomenclature scientifique, tandis que piroplasme appartiendrait davantage au langage courant – ça fait quand même plus chic de dire « Mon chien a une babésiose » que « Mon chien fait une piro », même si l’un n’est pas plus réjouissant que l’autre. Eh bien, il y a un peu de ça, mais pas seulement.
Les premières Babesia ont été observées en 1888, dans des globules rouges de bovins, par le biologiste Roumain Victor Babes (d’où Babesia), alors qu’il recherchait les causes d’une épizootie ayant causé la mort de 50 000 vaches dans la plaine du Danube. Au cours des années suivantes, des biologistes américains mirent à leur tour en évidence des parasites semblables dans les globules rouges de bovidés au Texas et en Afrique du sud, et du fait leur forme en poire, les baptisèrent d’abord Pyrosoma, puis Piroplasma. S’ensuivirent quelques décennies de très sévères polémiques entre biologistes roumains, allemands et américains, pour savoir qui avait découvert quoi en premier, et quels seraient les noms les plus légitimes. Faut-il y voir une tentative pour mettre tout le monde d’accord ? Toujours est-il que dans la classification, nos petits parasites appartiennent aujourd’hui à l’ordre des Piroplasmida, à la famille des Babesiidae, et au genre Babesia. On pourra toujours dire que techniquement, l’ordre des Piroplasmida regroupant les genres Babesia et Theilaria, la dénomination « piroplasme » est moins précise que « Babesia », mais en pratique, on emploie indistinctement les termes piroplasmose et babésiose pour désigner la maladie.
Voilà, c’était la minute culturelle du jour, bien intéressante quoique pas forcément facile à placer dans un dîner. Et maintenant, c’est parti pour l’étude de la piroplasmose – ou de la babésiose.
Le parasite
Les Babesia sont des protozoaires, à savoir les créatures les moins évoluées du règne animal, constituées d’une seule cellule. Aux dernières nouvelles, il existerait une vingtaine d’espèces de Babesia (plus d’une centaine si on commence à compter toutes les variations génétiques détectées ces dernières années), dont sept détectées chez les chiens, et quatre présentes en Europe ; trois grandes (longueur comprise entre 3 et 5,5 µm : Babesia canis, Babesia vogeli et Babesia rossi), et une petite (1 à 3 µm : Babesia gibsoni). On se limitera évidemment à ces dernières !
On l’a vu, les Babesia se présentent dans les globules rouges (= hématies) sous forme de poires : des fois une, d’autres fois deux, ou quatre (en « croix de Malte »), ou plus, et parfois elles n’ont pas du tout la forme de poire : elles peuvent être rondes, un peu tordues, en bâtonnet… on les trouve aussi dans des globules blancs (macrophages), quand elles se sont faites manger, ou hors de toute cellule quand leur globule rouge a éclaté. On verra tout ça en images, chemin faisant.

Seuls, par deux ou par quatre, en poire ou arrondis, les piroplasmes ont envahi près d’un tiers des hématies chez ce chien.
Alors, à quoi ça ressemble, la vie d’une Babesia ? Bon, il y a plus fun, mais c’est comme ça, on ne choisit pas sa vie. Certains passent la moitié de leur temps à la montagne et l’autre moitié à la mer, Babesia, (on va prendre l’exemple de Babesia canis), ce sera la moitié dans une tique et l’autre moitié dans un chien. L’arrivée dans le chien se fait par morsure d’une tique. Nos Babesia se retrouvent dans le sang du chien, et pénètrent dans une hématie. Là elles se multiplient, l’hématie finit par éclater, chaque nouvelle Babesia pénètre dans une nouvelle hématie où elle se multiplie, etc. Voilà pour la partie « chien ».
L’hématie a éclaté, et les Babesia (ici, au stade de mérozoïtes) sont libérées dans le sang. Toujours en nombre pair, (huit d’un côté, seize de l’autre), puisqu’elles se multiplient par divisions binaires.
Sur ce arrive une tique qui va aspirer le sang du chien, et les Babesia avec. Et là commence la partie sexuée du cycle, parce que oui, les Babesia ont aussi une sexualité, et ça se passe dans la tique – c’est moins romantique qu’un clair de lune, mais chacun fait comme il peut. Bon, on simplifie, on ne va pas donner les noms de tous les différents stades, juste les principaux ; donc, ceux de nos parasites qui ont survécu à la migration vont fusionner deux par deux pour donner un « zygote », qui va rentrer dans les cellules de la paroi de l’intestin de la tique et s’y transformer en un « ookinète » mobile. Celui-ci va se multiplier avant de sortir des cellules de l’intestin, et d’envahir tous les organes de la tique, y compris les ovaires, (du coup, les Babesia se transmettront d’une génération de tique à l’autre), et les glandes salivaires (où les Babesia sont dans les starting-blocks, prêtes pour infecter un nouveau chien, quand celui-ci sera mordu par la tique). Un point important, on y reviendra plus loin : les Babesia ne commencent à passer chez le chien que deux ou trois jours après la morsure de la tique. (Mais les Ehrlichia, également transmises par Rh. sanguineus, passent dans les trois heures : il faudra quand même en tenir compte !)
Pour terminer, sur la centaine d’espèces de Babesia existantes, quelles sont celles qu’on trouve en France, chez le chien ? Essentiellement, pour ne pas dire (quasi) uniquement deux : Babesia canis (en gros, partout sauf sur le pourtour méditerranéen), et Babesia vogeli (en gros, que sur le pourtour méditerranéen). Ces deux espèces sont indiscernables à l’œil nu – enfin, au microscope – il faut étudier leur génome pour les différencier, mais au demeurant, cela ne présente pas trop d’intérêt, même si Babesia vogeli serait peut-être un peu moins méchante que Babesia canis. Les autres tiques potentiellement présentes en France, (Babesia gibsoni et Babesia vulpes), sont anecdotiques.
Concernant notre environnement géographique proche, une thèse très exhaustive de 2015 sur la transmission des babésioses en France, et une précédente étude de la même auteure (M. René, Veterinary Parasitology, 2012) portant sur la caractérisation des Babesia chez les chiens présentés dans notre clinique de Villevieille, ont montré que sur 49 sangs de chiens (12 malades, 37 sans symptôme), vivant dans le département du Gard (prélevés dans nos cliniques de Villevieille et de Calvisson, et dans celle de Saint-Gilles), les 12 malades étaient infectés par Babesia vogeli, 1 chien sain par Thelaria annae, et aucun par Babesia canis. En ce qui concerne les tiques, sur 121 prélevées sur des chiens ou collectées dans le milieu extérieur (100% de Rhipicéphalus sp), 20 (16,5%) étaient porteuses de Babesia vogeli, et 3 (2,5%) de Babesia canis. Il apparaît donc que dans notre région, Babesia vogeli est très prédominante, par rapport à Babesia canis.
Où, quand, comment ?
Où ?
On exagèrerait à peine en disant que la piroplasmose est présente partout en France… sauf dans le sud-est :
il y a quand même quelques autres régions, (Bretagne, Normandie, Nord…), où l’on n’en voit pas beaucoup non plus, et on en trouve quand même un peu dans le sud-est, par exemple dans les départements du Gard – on vient d’en voir des illustrations – du Vaucluse ou des Bouches-du-Rhône. On y est bien loin, malgré tout, des incidences observées dans le Sud-Ouest (surtout), le centre, l’est ou la région parisienne. Autrement dit, si l’on voit arriver un chien fiévreux le lundi matin dans l’une de nos cliniques du Gard, la suspicion de piroplasmose sera beaucoup plus forte si l’on sait qu’il a passé la semaine précédente dans les Pyrénées, que s’il s’est contenté d’une balade en bord de mer, entre Palavas et La Grande Motte.

Incidence de la babésiose canine en France, en 2010. Source : HALOS, Lénaïg, LEBERT, Isabelle, CHAO, Isabelle, VOURC’H, Gwenaël, DUCROT, Christian, ABRIAL, David, RAVIER, Jean-François et GUILLOT, Jacques. Questionnaire- based survey on distribution and clinical incidence of canine babesiosis in France. BMC veterinary research. 2013. Vol. 9, pp. 41. DOI 10.1186/1746-6148-9-41. (Cité par L. de Gevigney).
Quand ?
Logiquement, l’infection des chiens se produit essentiellement quand les tiques sont les plus actives, au printemps et à un degré moindre, à l’automne : les résultats d’une enquête menée dans le Gard entre janvier 2010 et mai 2012 ont montré une corrélation entre le nombre de tiques collectées sur des chiens dans des cliniques vétérinaires (100% de Rh. sanguineus), les cas de babésiose essentiellement dus à Babesia vogeli, et les températures extérieures (graphiques ci-dessous). Les tiques ont surtout été trouvées sur les chiens entre mars et septembre, avec un pic d’infestation en avril, tandis que les cas de babésiose étaient diagnostiqués entre mars et juillet.
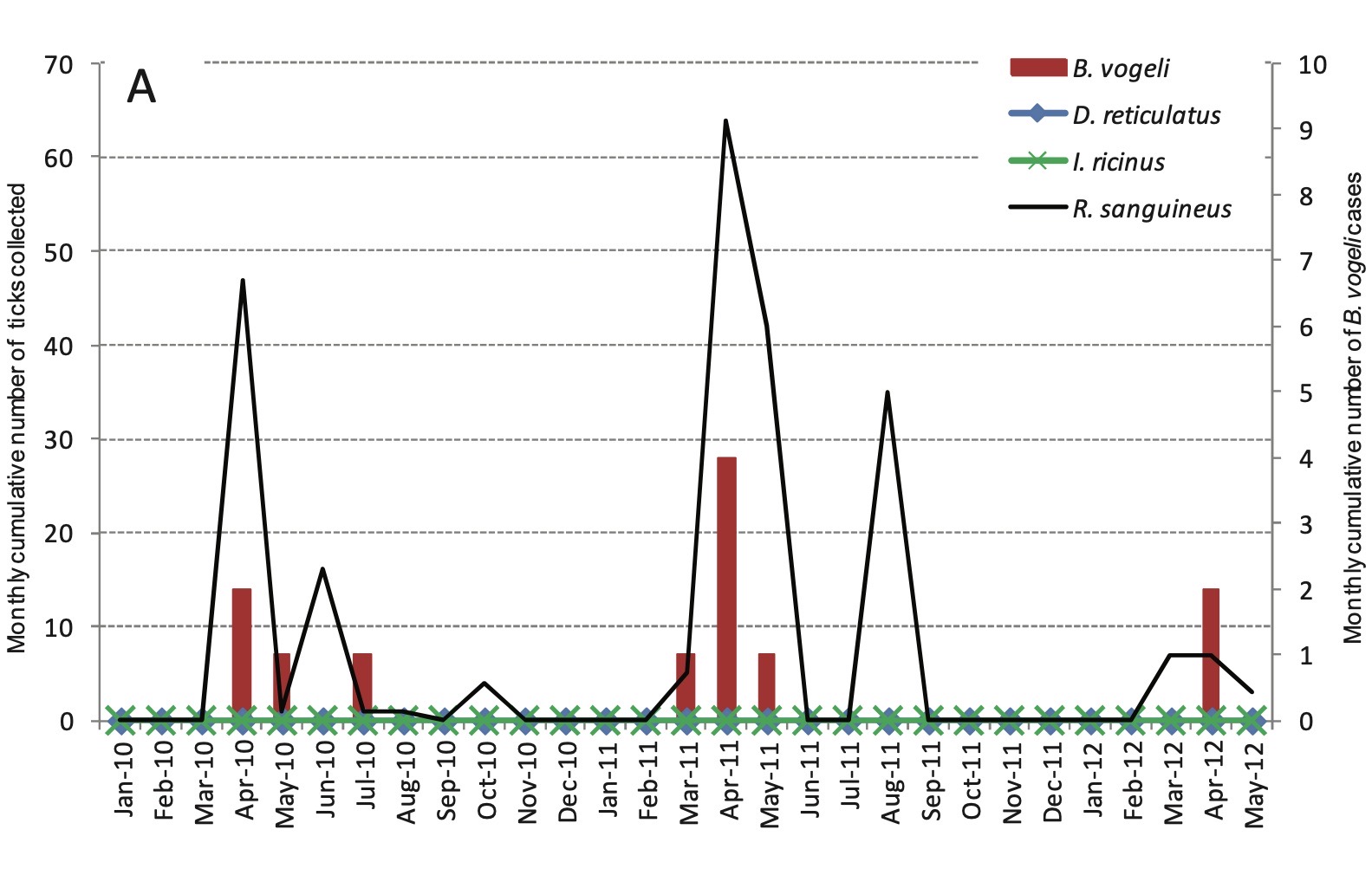

Corrélation entre le nombre de tiques collectées et les cas de babésiose à B. vogeli (à gauche) et les températures extérieures (à croite) dans le Gard, entre janvier 2010 et mai 2012. Source : M. René-Martellet & coll : Piroplasms of dogs and R. sanguineus ticks in southern France: epidemiological aspects and evolutionary perspectives (2015).
Gardons-nous tout de même d’exclure la possibilité d’une piroplasmose, au motif que nous sommes en hiver : Cibelle, dont nous verrons la photo un peu plus loin, a attrapé sa piroplasmose début janvier !
Comment ?
Ce n’est plus un scoop depuis le temps qu’on en parle : les chiens attrapent essentiellement la piroplasmose par morsure de tique. Rhipicephalus sanguineus (la tique brune du chien, ou tique des chenils) pour Babesia vogeli, dans les régions tropicales, sub-tropicales et méditerranéennes, Dermacentor reticulatus pour Babesia canis, dans les régions plus froides. Les tiques feront l’objet d’un article à venir sur les parasites externes du chien, on se limitera donc ici à quelques mots sur leurs interactions avec les Babesia.
Des deux tiques qui nous intéressent ici, Dermacentor reticulatus a une préférence pour l’extérieur et les lieux humides, tandis que Rhipicephalus sanguineus se plaît bien dans les habitations et les lieux plus secs. (Donc, logique que la première vive au nord, et la seconde au sud). Les deux espèces ont un cycle triphasique, c’est à dire que la larve, la nymphe et l’adulte prennent un unique repas sanguin sur un hôte, et entre deux repas, redescendent par terre, un peu pour digérer, et surtout pour muer (la larve et la nymphe) ou pour pondre (la femelle adulte).
Bon, donc notre Rhipicephalus sanguineus, puisque c’est surtout elle qui nous intéresse dans le sud, est juchée sur son brin d’herbe, et attend sa proie. Lorsque celle-ci se présente, (de préférence un chien, les larves et les nymphes pouvant se satisfaire de rongeurs et autres petits mammifères), la tique lui grimpe dessus, cherche le lieu adéquat, puis perce la peau avec ses pièces buccales, et commence son repas sanguin qui va durer entre trois et sept jours, avec une alternance de phases d’aspiration et d’émission de salive. Ce faisant, elle s’infecte en aspirant le sang si le chien était porteur de Babesia, et elle infecte le chien avec sa salive, si elle était elle-même porteuse. On l’a vu, les Babesia ne seront injectées dans le chien que deux à trois jours après la fixation de la tique. Le repas terminé, la tique se détache, tombe par terre, et commencera bientôt à pondre des milliers d’œufs après quoi… elle meurt. Et pouf. Après quelques jours ou semaines, les œufs éclosent, et il en sort des larves qui partiront à leur tour à la recherche d’un hôte à qui pomper le sang, puis les larves mueront pour donner des nymphes, et enfin les nymphes, des adultes. Il peut y avoir trois ou quatre cycles de ce genre par an, et plus il fait chaud, plus ça va vite ! Signalons qu’une tique adulte peut rester plus d’un an sans manger – ce qui laisse tout de même rêveur.
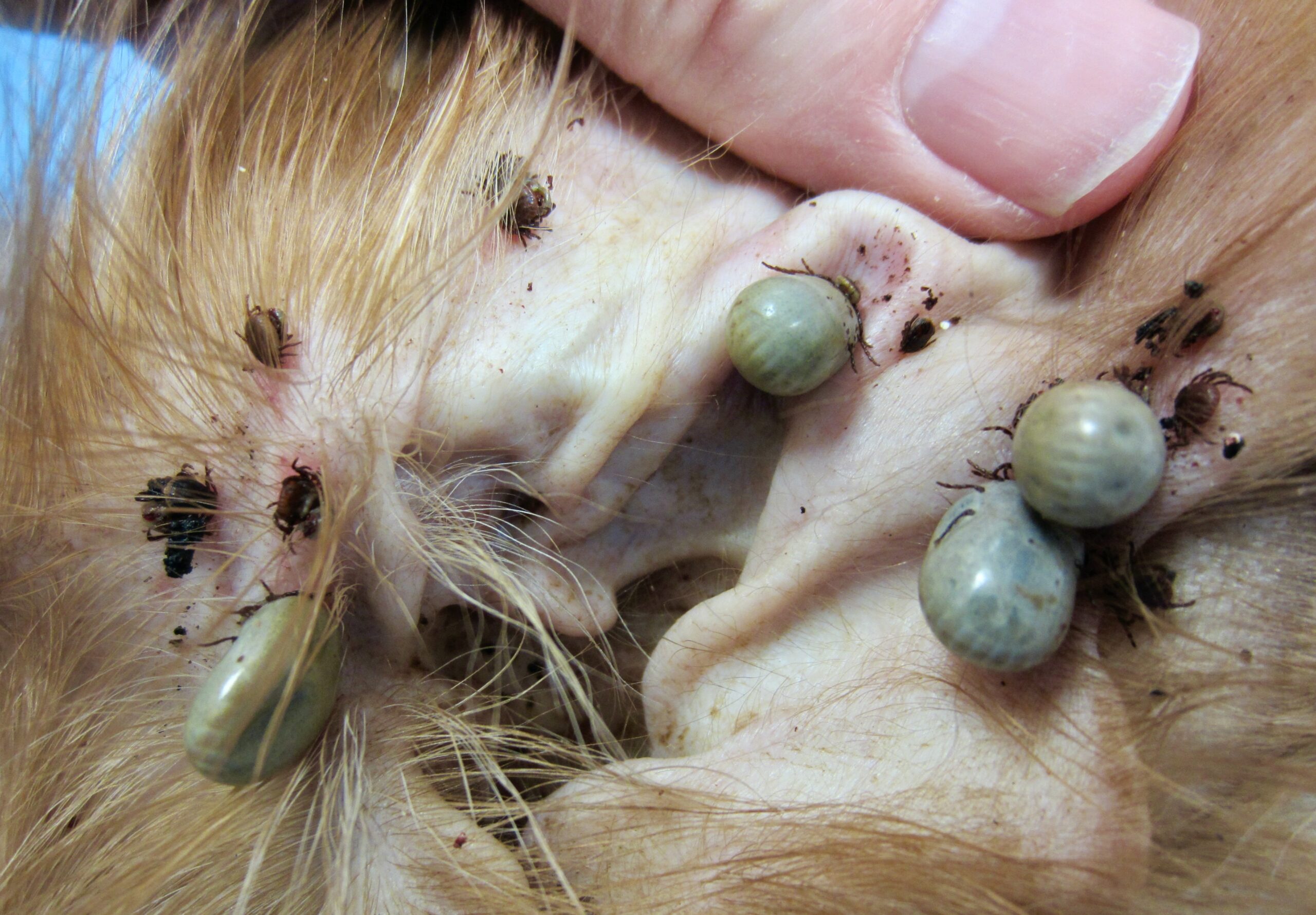
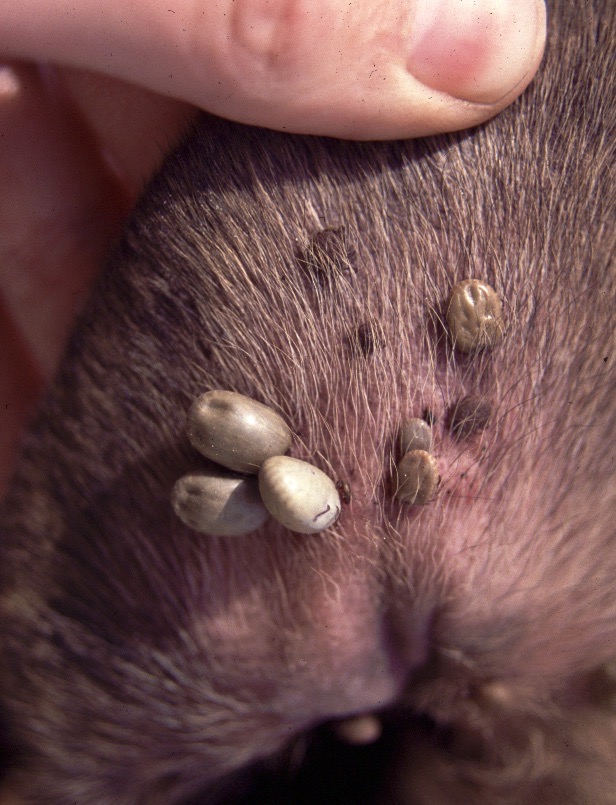
Celles-ci ne pourront pas dire qu’elles sont restées un an sans manger. Photo de gauche : c’est la fête ! A droite : gros plan sur une femelle Rhipicephalus sanguineus adulte et gorgée.
Les babésies peuvent passer d’une génération de tique à l’autre par transmission transovarienne (de maman tique aux bébés tiques), mais aussi de la tique mâle à sa descendance, si le spermatophore est infecté. Il existe également une transmission trans-stadiale des babésies, de la larve à la nymphe, et de la nymphe à l’adulte : les tiques jouent donc un rôle de réservoir pour la maladie, au même titre que certains chiens infectés chroniques.
Sinon, en dehors des tiques, la piroplasmose se transmet de la chienne aux chiots à travers le placenta, et de chien à chien par transfusion sanguine : on pourrait penser que ce n’est vraiment pas de chance qu’un chien donneur soit justement porteur sain de piroplasmes, mais ça s’est vu, en des temps lointains où il n’existait pas de PCR pour tester les donneurs.
Et dernière précision : il n’y a pas que les babésies qui se font transporter par Rh. sanguineus : la tique peut aussi transmettre au chien Ehrlichia canis, Anaplasma platys, Hepatozoon canis, plus quelques autres… et parfois tout cela à la fois !

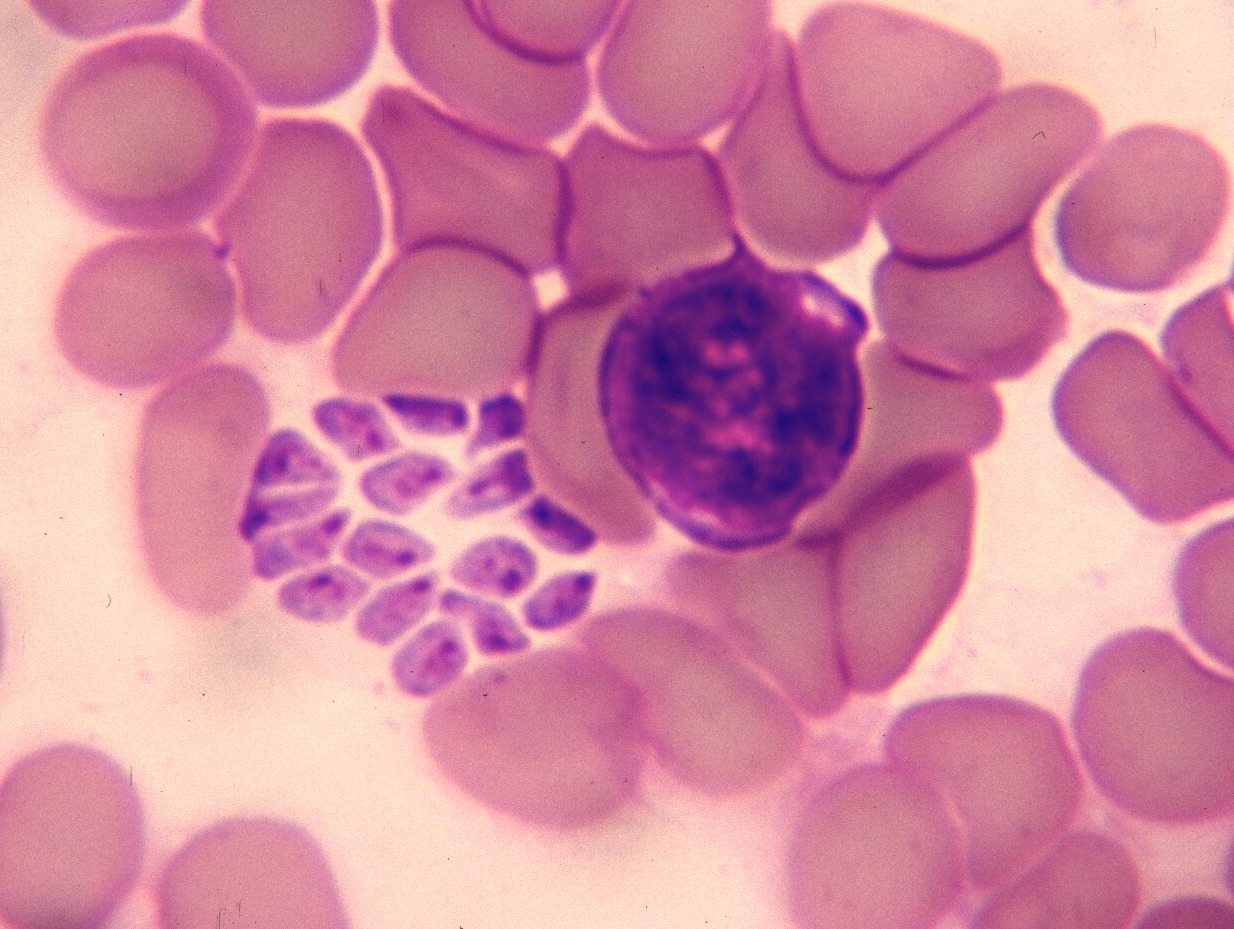
Un gamétocyte d’Hepatozoon canis (flèche bleue) dans un polynucléaire neutrophile, et quatre piroplasmes dans leurs hématies respectives (flèches noires), sur le frottis sanguin d’un chien présentant un abattement et une hyperthermie. Alors d’accord, la photo n’est pas bien nette, c’est une diapo (argentique), déjà floue au départ, et qui a été scannée. Mais on l’a mise quand même, parce que ce n’est pas tous les jours qu’on trouve des Hepatozon et des Babesia côte à côte sur le même frottis !
Au-delà d’illustrer la transmission des deux parasites par une même tique, ce cas pose la question des co-infections : une première infection, en diminuant l’immunité d’un chien, peut favoriser l’installation d’un deuxième (et pourquoi pas d’un troisième, d’un quatrième…) agent pathogène. Voir aussi plus loin le cas de Biscotte. (Dans la partie Traitement).
Quels symptômes ?
On en a parlé, et on l’a vu en photo, les babésies infestent les globules rouges, dont elles provoquent l’éclatement : d’abord, elles en fragilisent la membrane, puis elles font monter la pression à l’intérieur (parce que mine de rien, elles occupent du volume), quelques mécanismes à médiation immune en plus, et le globule rouge éclate, d’où une anémie hémolytique (= anémie par destruction des hématies). S’y ajoute une réaction inflammatoire due à l’infection parasitaire elle-même, et voilà qui explique les principaux symptômes. Dans les cas les plus graves, hémolyse plus inflammation provoquent en outre une atteinte des reins, du foie, voire du cerveau ou des poumons. Des CIVD (coagulations intra-vasculaires disséminées) sont également décrites. Toutes ces complications assombrissent évidemment le pronostic.
Alors, concrètement, qu’est-ce que ça nous donne comme symptômes ? Déjà, on a de la chance dans le sud : les symptômes dus à Babesia vogeli sont moins marqués, et le pronostic meilleur, qu’avec Babesia canis, ou a fortiori Babesia gibsoni. Tout commence entre deux jours et trois semaines après la morsure de la tique – mais en général, on est plutôt en bas de cette fourchette. Une étude a récapitulé les symptômes observés chez 836 chiens atteints de piroplasmose un peu partout en France, entre octobre 2006 et décembre 2007 (M. Renet-Martellet & coll, Vet Parasitol, 2013) : le trio gagnant est incontestablement abattement (98 % des cas), anorexie (98 % également), et hyperthermie ≥ 39°C (80 %). Ensuite, viennent la pâleur des muqueuses (54 %), les urines colorées (45 %), et la splénomégalie = augmentation de taille de la rate (33 %). Un ictère (= jaunisse) ou des vomissements sont moins souvent observés.
Après, on décrit des symptômes plus rares, comme une toux, une diarrhée, voire des convulsions. Nous avons assez fréquemment observé des douleurs (voir ci-dessus le cas d’Anouck, et ci-dessous celui de Cibelle), ce qui est assez peu rapporté dans les publications. Et puis, il n’y a pas que des formes aiguës, on rencontre aussi des formes plus chroniques, avec des chiens un peu fatigués depuis plusieurs mois, (mais on se dit : Oh, ben il vieillit, il bouge moins), qui se traînent une anémie chronique, voire qui n’ont aucun symptôme (apparent)… Et puis un jour, sur leur dixième frottis sanguin en six mois, on finit par trouver un piroplasme ! Bon, ça, c’était avant la PCR, parce qu’aujourd’hui, un chien fatigué ou anémié de façon chronique, on lui cherche par PCR les principales maladies transmises par les tiques, et on trouve la piro beaucoup plus rapidement. Tous ces chiens-là, on leur fait le traitement de la piroplasmose (une seule injection : voir plus loin) et pouf ! Ils retrouvent la forme en 24-48 heures.

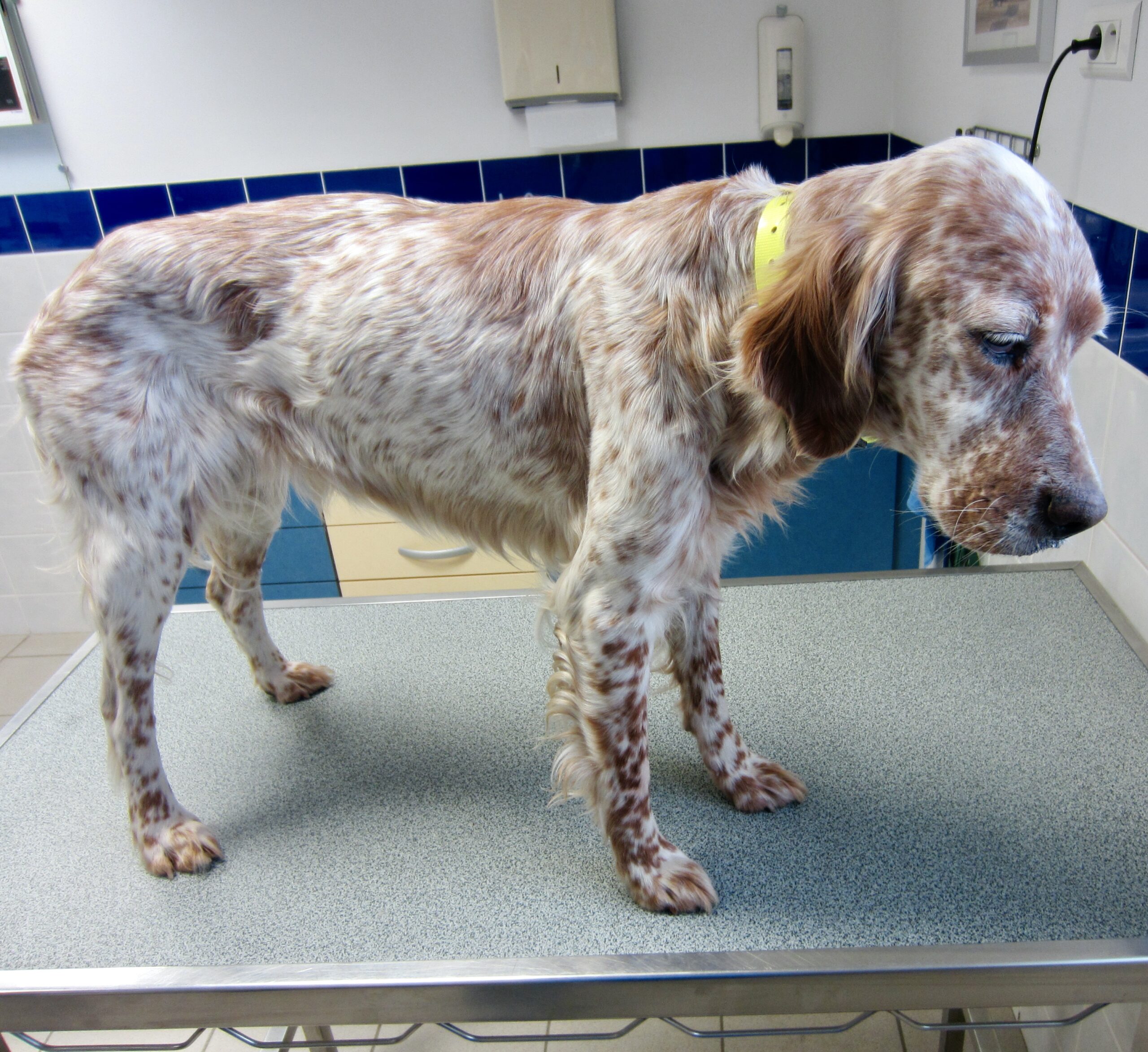
Voici Cibelle, Setter anglais de neuf ans, dont nous avons déjà parlé un peu plus haut – c’est elle, qui a fait sa piro en janvier. Le jour de la consultation, Cibelle présentait depuis une semaine un abattement important (photos du haut), une baisse d’appétit et des douleurs. Les muqueuses étaient pâles, et les urines colorées et épaisses. La chienne avait beaucoup maigri (photo ci-dessus), ce qui est relativement inhabituel, car vu le caractère le plus souvent aigu de l’infection, les chiens ont rarement le temps de maigrir à ce point.
D’un point de vue biologique, on décrit avant tout l’anémie, habituellement régénérative : c’est à dire que comme il y a plein de globules rouges détruits en même temps, la moelle osseuse (qui n’est pas atteinte), va en fabriquer de nouveaux et les larguer dans la circulation un peu dans l’urgence, alors qu’ils ne sont pas encore vraiment finis. Du coup, on va voir sur le frottis sanguin des globules rouges immatures, de différentes tailles et de différentes couleurs, certains même avec un noyau (voir la photo en tête d’article, et d’autres un peu plus loin). Le taux de plaquettes sanguines est aussi fréquemment diminué (thrombopénie). Pour les globules blancs, on a souvent une augmentation du pourcentage de cellules mononucléées : on en reparle dans la partie Diagnostic. D’un point de vue biochimique, c’est beaucoup plus inconstant, avec une possible élévation des enzymes hépatiques et, toujours embêtant, une augmentation de l’urée et de la créatinine en cas d’atteinte rénale. Côté urines, on trouve souvent de l’hémoglobine, des protéines et de la bilirubine.
Le diagnostic
Clinique
Il n’est pas spécifique, mais peut quand même bien orienter : c’est sûr que si on voit arriver, en avril, un chien qui a passé le week-end précédent à se promener dans la campagne du côté de Toulouse, qu’on lui trouve des tiques un peu partout, et qu’il est abattu, fiévreux, avec des urines couleur marc-de-café… on fera évidemment un frottis sanguin pour être sûr, mais il n’y aura pas trop de doute quant à ce qu’on va trouver. Après, attention quand même aux raccourcis trop rapides : moins de la moitié des chiens à piro ont les urines colorées, et à l’inverse, pas mal de maladies autres que la piro peuvent donner un abattement et des urines foncées. Sans parler, on l’a vu, des chiens atteints de babésiose chronique, avec peu de symptômes.
Cytologique
La piroplasmose a ceci de satisfaisant que c’est l’une des rares maladies graves, (quand le chien arrive, il est souvent mal mal), dont on peut avoir un diagnostic de certitude sur place, en quelques minutes, et qu’on guérit le plus souvent en 24 heures avec une seule injection… mais on reparlera de ce dernier point un peu plus tard.
Donc, le diagnostic de laboratoire passe avant tout par le frottis sanguin, réalisé « au chevet du patient », si tant est que le chien ait un chevet. On cherchera deux choses sur le frottis : les piroplasmes, et les modifications de la formule sanguine.
Concernant les piroplasmes, on en a déjà vu quelques exemples plus haut, et ils ne posent généralement pas de problème d’identification. D’abord, la plupart ont cette forme en poire caractéristique qui a donné son nom à la maladie, ou à défaut, une forme plus ou moins circulaire, assez classique. Et puis le plus souvent, il y en a plein partout : pas la peine de chercher trois heures, en une minute on en a déjà vu plusieurs, parfois même dès le premier champ microscopique. Alors comme toujours, il y a des exceptions : il nous est arrivé, chez un chien à anémie hémolytique avec une formule sanguine pas du tout évocatrice, (une forte neutrophilie), de trouver une belle paire de piroplasmes après… deux heures de recherche sur frottis sanguin, et une heure sur frottis de moelle osseuse. Bon, aujourd’hui, après dix minutes de recherche infructueuse, on demanderait une PCR, mais c’est histoire de dire qu’il y a quand même des cas où les Babesia ne sont pas si faciles à mettre en évidence.
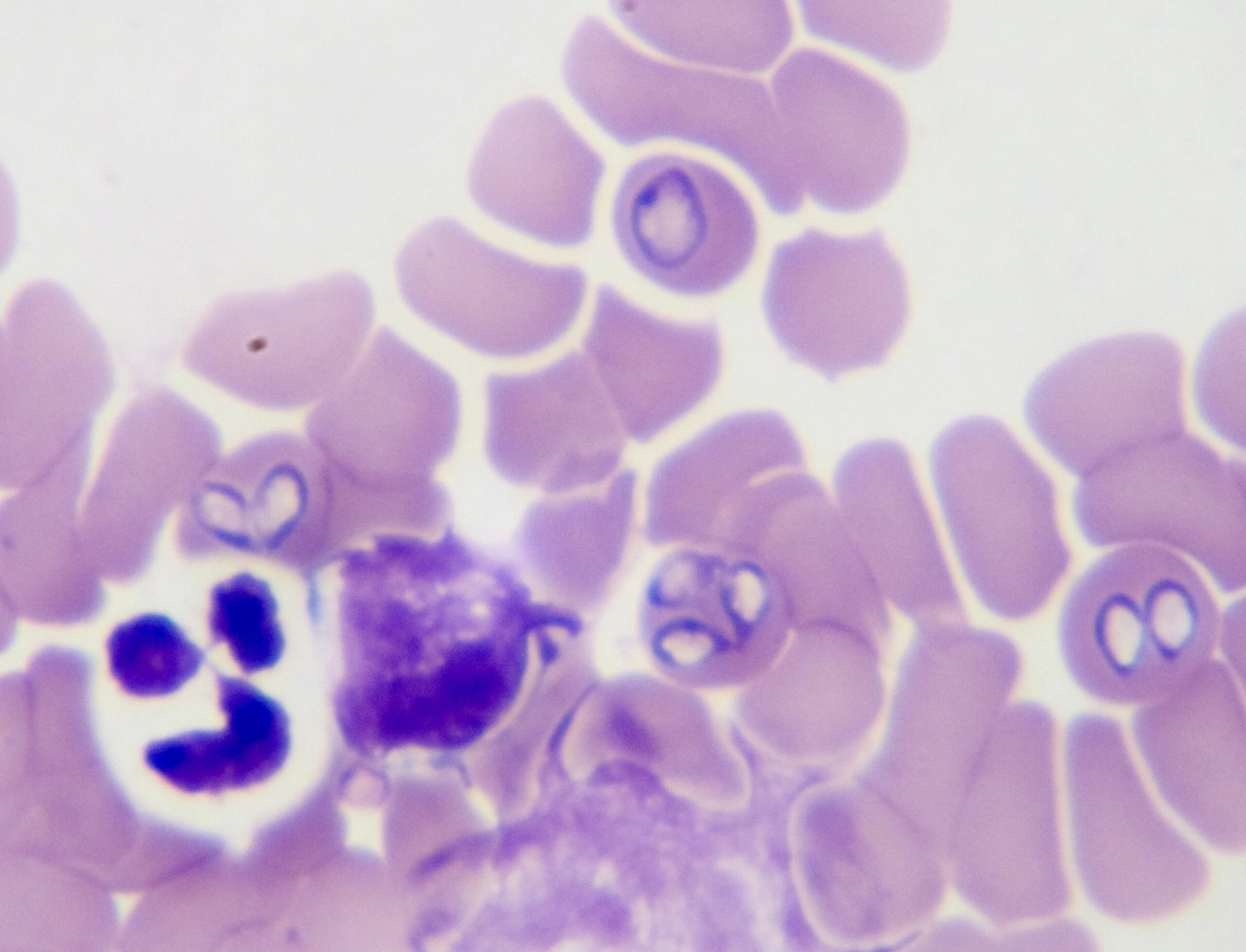
Photo de gauche : la plupart des piroplasmes ont ici leur forme de poire bien typique. L’un d’eux (en haut) a une forme plus ovalaire. A droite : certains piroplasmes ont encore une forme en poire (à droite), ou du moins allongée, mais les six agglutinés dans l’hématie en haut à gauche ne ressemblent plus du tout à des poires ! Et on comprend que quand ils auront un peu grossi, quel que soit, par ailleurs, l’état de la membrane du globule rouge, celle-ci aura du mal à résister à la pression interne.

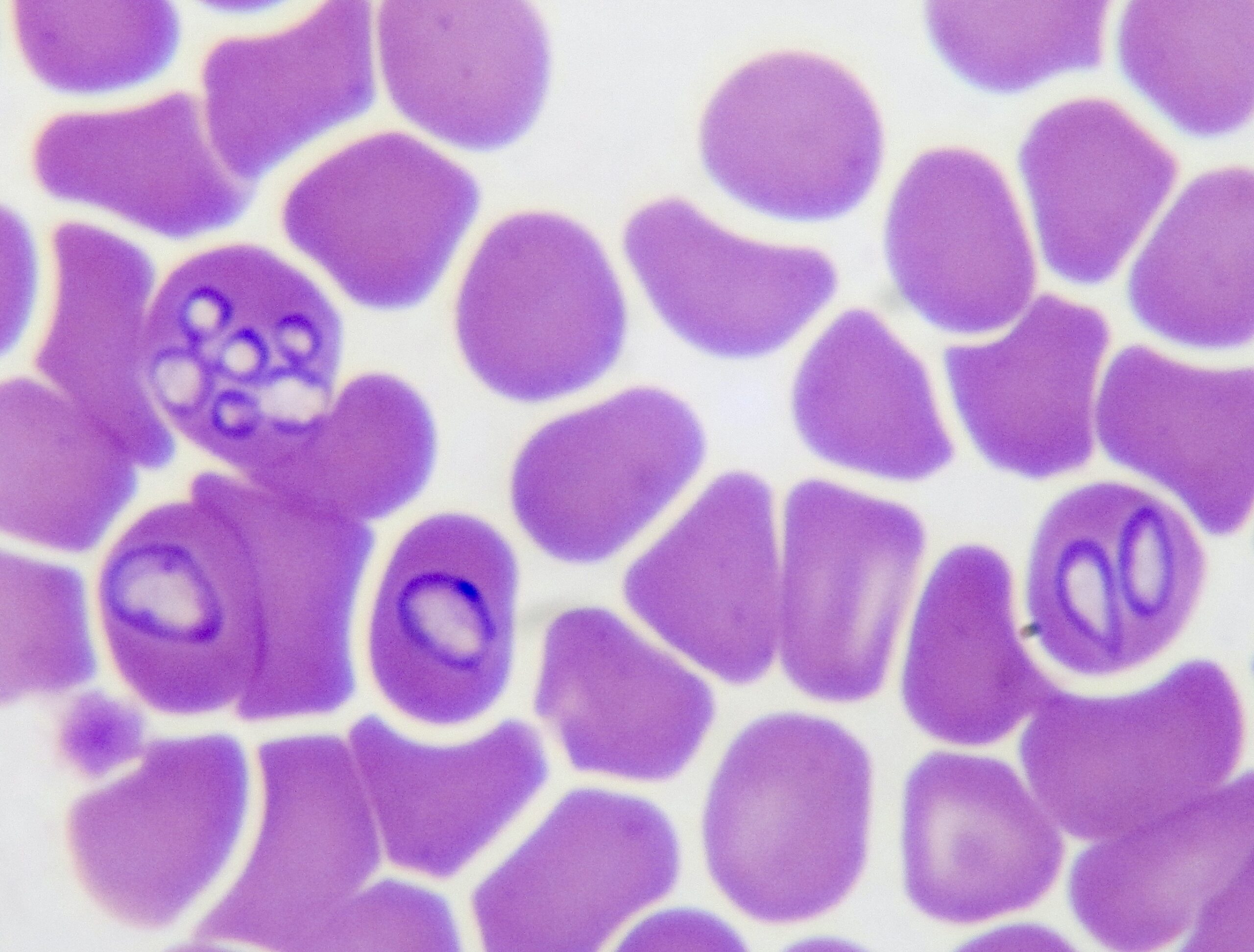
Trois photos montrant des piroplasmes d’aspect moins habituel, chez le même chien. En haut et ci-dessus à droite : une forme allongée, en bâtonnet, qui va d’un bord de l’hématie à l’autre (flèches). On se doute bien qu’il doit s’agir de piroplasmes, mais c’est tout de même rassurant d’en voir deux de forme plus typique, dans la moitié gauche de la photo du haut. Ci-dessus à gauche : toujours chez le même chien, un piroplasme en division, d’aspect inhabituel.

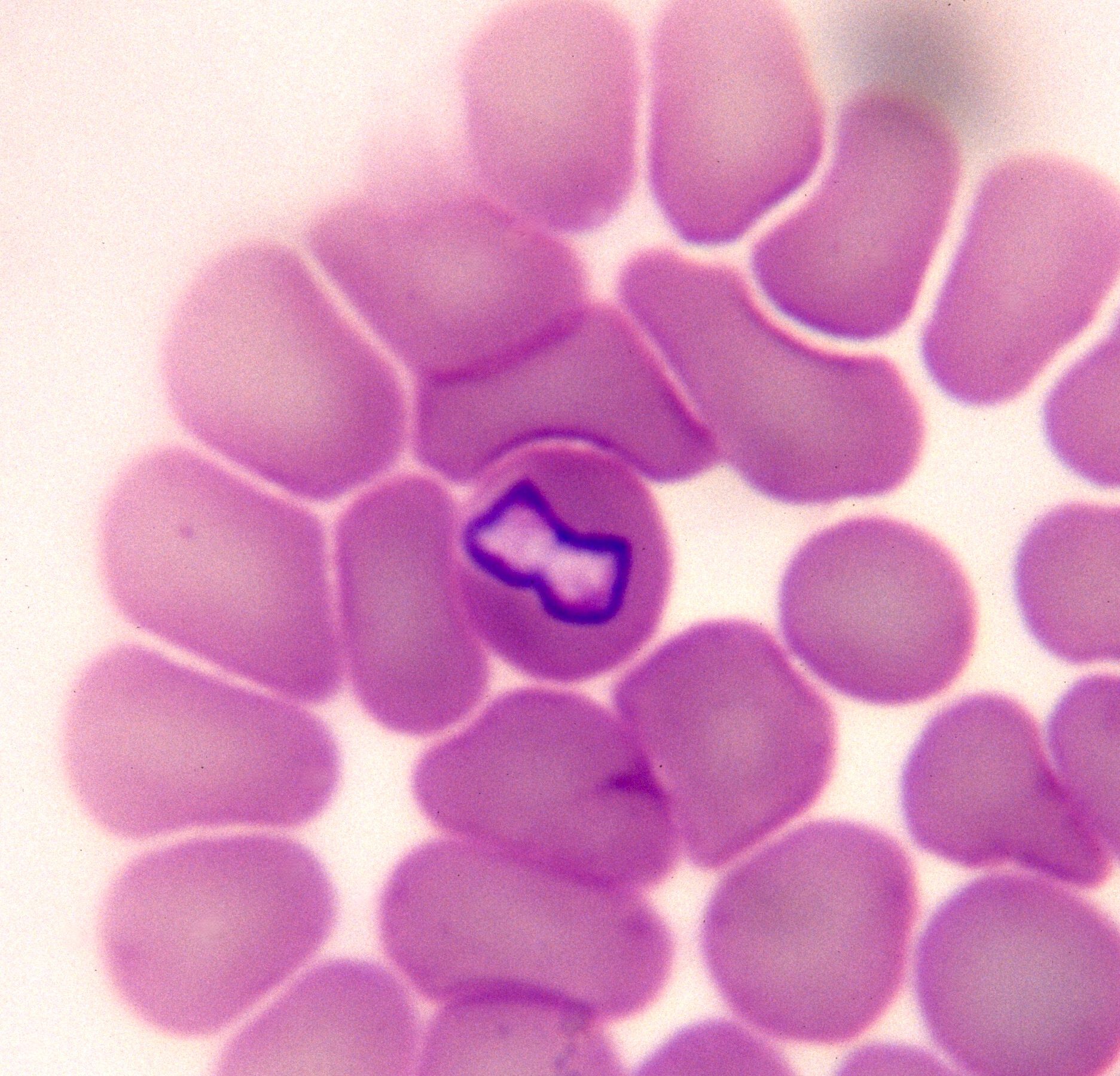
Encore un piroplasme bien tarabiscoté (flèche) chez Anouck, que nous avons vue en photo un peu plus haut. Plusieurs gros monocytes et macrophages sont présents sur la partie gauche de la photo, on en reparle ci-dessous.
Un signe indirect précieux – mais parfois trompeur – sur le frottis sanguin, est la présence d’un pourcentage élevé de cellules mononucléées, et notamment de macrophages. Ces derniers sont de grandes cellules, résultat de la transformation d’un monocyte, qui ont pour mission de phagocyter (= ingérer et détruire) les cellules abîmées, les bactéries et autres grosses particules qui n’ont rien à faire là ; des sortes d’éboueurs de l’organisme, en quelque sorte. Quand on en voit un fort pourcentage sur un frottis sanguin, ça incite à passer un peu de temps à chercher le piroplasme… ou à demander une PCR, si décidément, on n’arrive pas à en trouver. Cela dit, la présence de grandes cellules mononucléées peut se rencontrer dans d’autres maladies, parasitaires ou pas !
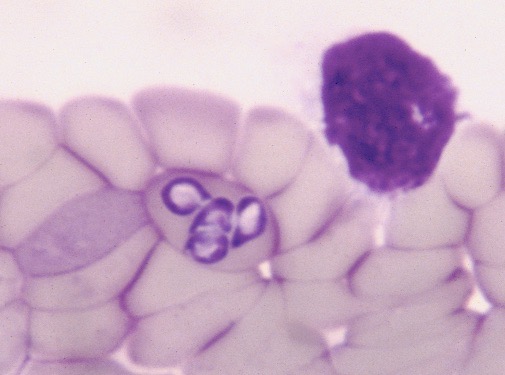
Deux photos du frottis sanguin d’un chien atteint à la fois de babésiose et d’ehrlichiose. A gauche, quatre piroplasme sont visibles dans une hématie. Sur la photo de droite, une hématie a été phagocytée et commence à être dégradée à l’intérieur d’un macrophage (flèche).
Sur les photos ci-dessus, ce sont maintenant les globules blancs qui sont intéressants ; sur la photo de gauche, que nous devons toujours à Anouck, au milieu de nombreuses cellules mononucléées, un macrophage a phagocyté et commencé à digérer une hématie dans laquelle on distingue encore trois piroplasmes assez mal en point (flèche noire). A droite de la photo, quatre petits piroplasmes sont visibles dans leur globule rouge encore intact (flèche rouge). Sur la photo de droite aussi, un macrophage a mangé des hématies mais là, la digestion est plus avancée et on ne distingue plus que les restes des piroplasmes qui se trouvaient à l’intérieur (flèche noire). Excepté deux polynucléaires neutrophiles (PNN) normaux, toutes les autres cellules sont des monocytes ou des macrophages. Une dizaine de piroplasmes sont visibles sur la moitié gauche de la photo.
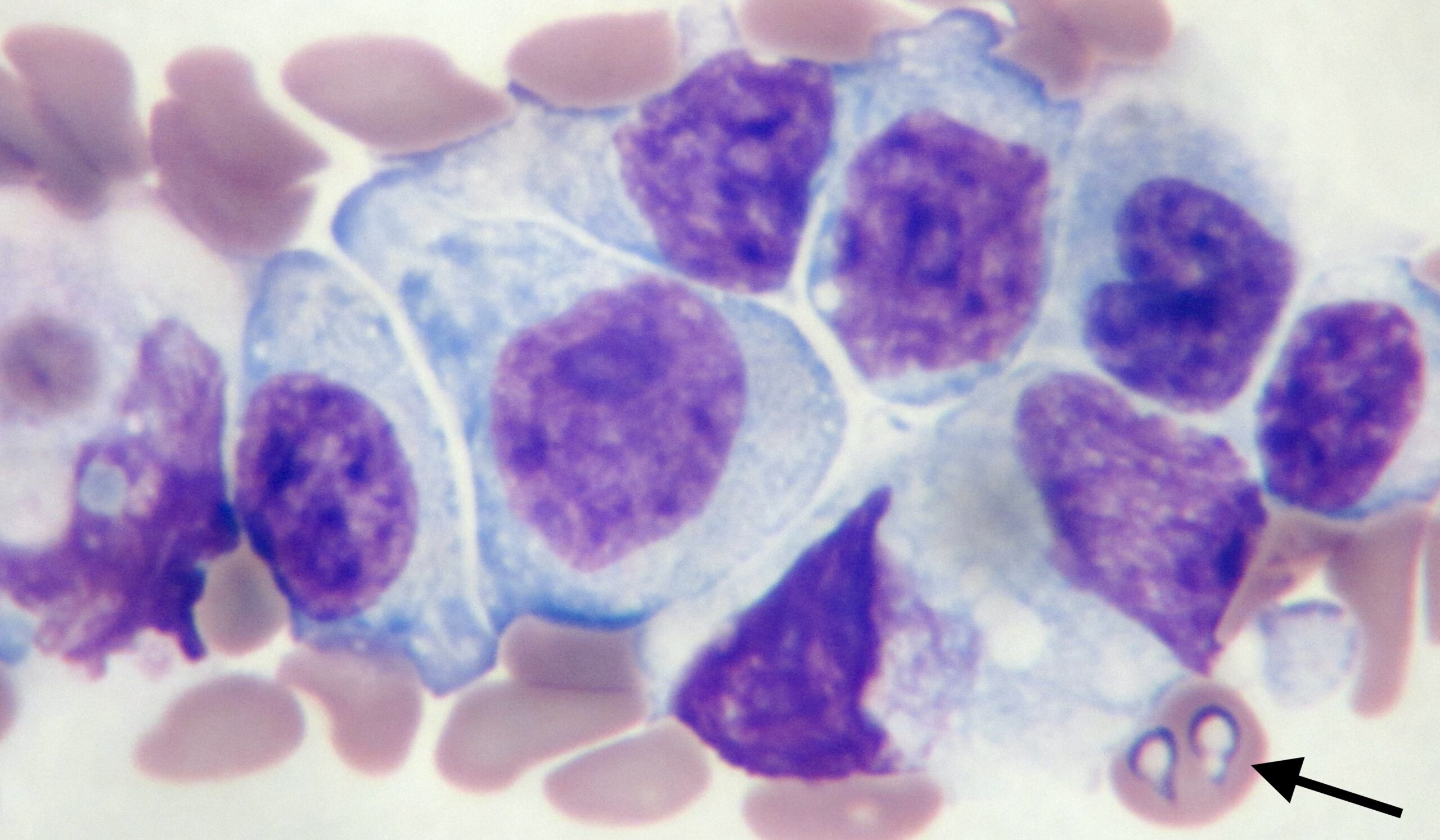
Alors, les monocytes, les macrophages, comme signes d’appel incitant à passer du temps sur le frottis sanguin en se disant qu’on finira sans doute par trouver des piroplasmes, c’est bien. Mais quand on tombe sur ces cellules géantes au cytoplasme basophile, avec de gros noyaux de taille et de forme variables (= anisocaryose), une chromatine mottée et des nucléoles… il serait bien tentant de conclure à une leucémie ! Heureusement qu’on a ces deux petits piroplasmes bien typiques dans un coin de la photo (flèche) pour nous ramener dans le droit chemin. (Encore une photo du frottis sanguin d’Anouck ; décidément…)
Moléculaire
Comme tout serial killer moyen, les babésies laissent traîner leur ADN un peu partout où elles passent. La PCR (pour Polymérase Chain Reaction, ou Amplification en Chaîne par Polymérisation, en français) est une méthode qui permet, à partir d’un échantillon peu abondant, d’obtenir rapidement une quantité importante et exploitable d’un segment précis d’ADN. C’est une méthode extrêmement sensible et spécifique pour détecter du matériel génétique de Babesia, même en très faible quantité, dans le sang d’un chien suspect. Bien utile, donc, si l’on pense que tel chien a une piro, mais qu’au bout de dix minutes (ou quinze, ou vingt, ou plus, selon l’amour que l’on éprouve pour son microscope), on n’a toujours pas trouvé de Babesia sur le frottis. Autre intérêt de la PCR : selon la technique utilisée, elle peut nous donner le nom précis de la babésie en cause : Babesia canis, Babesia vogeli, Babesia gibsoni… Intérêt qui pourra sembler purement théorique, mais quand même pas seulement, puisque certains piroplasmes sont plus méchants que d’autres. (On l’a vu avec Babesia vogeli, qui provoque des symptômes moins marqués, en général, que les autres espèces). Et puis accessoirement, c’est toujours intéressant de savoir qu’on a affaire à une Babesia qu’on ne trouve habituellement que dans d’autres coins de la planète. Dernier intérêt de la PCR : si l’on suspecte une babésiose, tant qu’à y être, autant rechercher sur le même prélèvement les maladies potentiellement associées, notamment l’ehrlichiose, également transmise par Rhipicephalus sanguineus, si l’on est dans une région où cette tique est prédominante.
Juste un mot, quand même, de la sérologie pour dire qu’elle présente peu d’intérêt dans le diagnostic de la babésiose : comme l’infection est souvent aiguë, la sérologie n’a pas eu le temps de se positiver quand le chien est présenté en consultation, et inversement, comme les anticorps persistent après la guérison, on risque de trouver positif un chien qui a eu une piro dans le passé et qui vient pour tout à fait autre chose. En caricaturant un peu, (à peine), on trouvera donc négatifs les chiens malades, et positifs les chiens guéris.
Le traitement
Alors attention, attention, attention : on le dit à chaque fois, mais le traitement, il se décide au cas par cas. Votre vétérinaire choisira le protocole le mieux adapté en fonction de l’état du chien, des résultats d’analyses, d’éventuelles maladies associées, mais aussi de sa propre expérience, des dernières données de la science, etc.
Donc, concernant la piroplasmose, on dira simplement que dans la majorité des cas d’infection par Babesia vogeli, (on le rappelle, l’une des moins méchantes), une seule injection d’imidocarb dipropionate suffira à guérir le chien, avec une amélioration visible en quelques heures seulement – ce qui, pour un propriétaire qui voyait son compagnon moribond le matin même, semble souvent tenir du miracle ! Après, comme indiqué plus haut, l’association à d’autres médicaments, une mise sous perfusion, un protocole différent pour l’imidocarb… peuvent être jugés préférables au cas par cas.
Et puis malheureusement, quelques cas sont plus compliqués, et lorsque l’on constate une atteinte sévère des reins et/ou du foie, une destruction des globules rouges très importante ou persistant après l’élimination du parasite, des troubles neurologiques… alors un traitement beaucoup plus lourd devra être mis en œuvre, avec un résultat final nettement plus incertain.

Un exemple de réponse au traitement de la piroplasmose : Biscotte est une golden retriever de sept ans, présentée en hypothermie, très abattue, avec d’importantes pertes vulvaires purulentes. Une ou deux semaines plus tôt, elle est déjà restée sans manger pendant trois jours. L’échographie montre plusieurs fœtus en décomposition à l’intérieur de l’utérus. Une ovario-hystérectomie est donc pratiquée, qui se déroule sans incident. Le lendemain, la chienne est toujours très fatiguée, en hypothermie, se lève difficilement, et ne mange quasiment pas (photo du haut : J+1 à 13 heures). Plusieurs tiques ayant été retirées pendant la préparation chirurgicale de Biscotte, un frottis sanguin est réalisé : il montre une forte mononucléose (photo du milieu à gauche), et quelques rares piroplasmes bien caractéristiques (photo du milieu à droite ; flèche). Biscotte reçoit une injection d’imidocarb. Les photos ci-dessus la montrent le lendemain de l’injection, avec son appétit retrouvé (J+2, 9:00), et visiblement très contente !
Les questions que l’on peut se poser : est-ce la piroplasmose qui a tué les fœtus ? Ou bien les fœtus morts qui ont favorisé l’installation de la piroplasmose par le biais d’un déficit immunitaire ? Ou bien les deux n’ont-ils aucun rapport ?
Et en prévention ?
Alors pour la prévention, nous avons une première ligne de défense qui repose sur la lutte contre les tiques, et pour celles qui arriveraient à passer, une deuxième ligne constituée par les vaccins.
La lutte contre les tiques
Nous disposons aujourd’hui de produits nombreux et efficaces, à appliquer sur le chien pour tuer ou repousser les tiques. Un certain nombre de colliers, sprays ou pipettes (« spot-on ») permettent non seulement de débarrasser le chien de ses tiques, mais exercent en plus un effet répulsif qui empêche les bestioles d’approcher, ou du moins de se planter – même si certaines y parviendront toujours quand même. Du moins le risque est-il bien diminué, car les quelques tiques qui arriveraient à passer au travers décèderont en général moins de 48 heures après s’être fixées, et on a vu que les piroplasmes ne commençaient à passer chez le chien que 48-72 heures après la morsure de la tique.
D’autres insecticides/acaricides se présentent sous forme de comprimés, qui tuent très efficacement les puces et les tiques présentes sur le chien, avec une activité persistante de un à trois mois selon le produit ; (deux mois maximum dans le cas de Rhipicephalus sanguineus). Depuis 2024, le principe actif de l’un de ces produits (le fluralaner), existe aussi sous forme injectable avec une activité persistant pendant un an. Ces produits en comprimé ou injectables présentent l’inconvénient, par rapport aux colliers et pipettes, de ne pas avoir d’effet répulsif. On pourra toujours dire que s’ils n’empêchent pas les tiques de venir sur le chien, comme ils les tuent très rapidement, l’inoculation des Babesia par la tique n’aura pas le temps de se faire.
Après, ne négligeons pas la méthode artisanale qui consiste à inspecter son animal au moins une fois par jour, notamment au retour de chaque promenade dans la campagne, et à retirer une à une les tiques qui auraient pu passer au travers, en dépit des répulsifs envisagés ci-dessus. Le retrait des tiques peut se faire à la main, ou mieux, avec un crochet anti-tiques spécialement conçu pour cet usage. Vous allez trouver qu’on se répète, (et c’est vrai qu’on se répète), mais avec des Babesia transmises 48 heures après la morsure, si l’on inspecte son chien une fois par jour, on diminue encore le risque d’infection.
Voilà, on fait sa petite inspection quotidienne, on soulève l’oreille du chien, et pouf ! Alors on peut toujours retirer les tiques à la main, le coup de « la tête qui reste à l’intérieur », ce n’est quand même pas bien fréquent, c’est le moins que l’on puisse dire, mais le crochet (photo de droite) évitera tout de même de toucher la tique avec les doigts, et de lui presser l’abdomen au risque de provoquer une régurgitation… et d’accélérer ainsi le passage des parasites dans le chien ! Une petite pulvérisation d’un spray anti-tiques directement sur la bestiole, ça peut être bien aussi, mais quand on l’enlève, au moins, on est sûr qu’elle ne pourra plus transmettre quoi que ce soit.
Mais… souvenons-nous quand même que les Ehrlichia, elles, sont transmises dans les trois heures suivant la morsure de Rhipicephalus sanguineus ! Donc tout ce qui peut repousser les tiques avant qu’elles aient eu le temps de mordre conserve tout de même son intérêt.
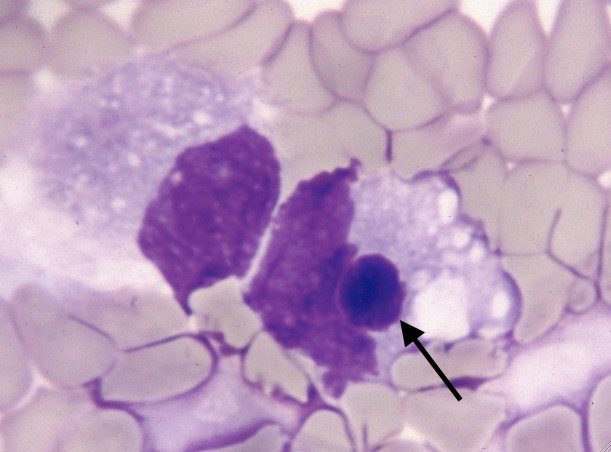
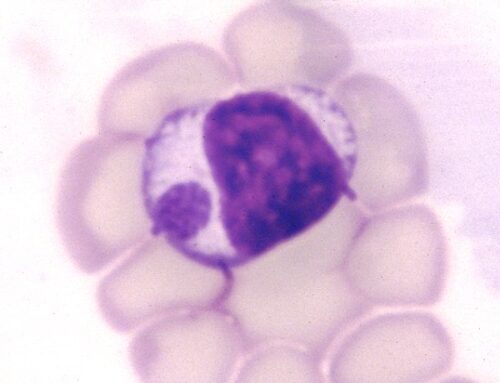
Photo ci-contre : une morula d’Ehrlichia canis (flèche) dans un lymphocyte.

Après, on peut bien utiliser les meilleurs produits du monde, on ne pourra jamais affirmer qu’aucune tique ne parviendra à se faufiler jusqu’au chien et à le mordre ! Et c’est là qu’intervient la deuxième ligne de défense, avec les vaccins.
Vaccins et chimioprévention
En 2024, il n’existe en France, qu’un seul vaccin contre la babésiose : le PIRODOG®. Il se fait à partir de l’âge de 5 mois, en deux injections espacées de 3 à 4 semaines, puis avec des rappels « annuels ou semestriels selon les risques épidémiologiques », est-il écrit dans le RCP (Résumé des Caractéristiques du Produit).
Il est recommandé de ne pas vacciner les chiens ayant eu une babésiose durant les 8 semaines précédentes (minimum), en sachant que plus globalement, le vaccin semble moins efficace chez les chiens ayant déjà eu la maladie. Pour ne pas risquer de vacciner un chien qui viendrait d’être contaminé, l’idéal est donc de vacciner en-dehors de la « saison des tiques », soit pendant l’hiver. En plus, comme l’efficacité au-delà de 6 mois semble moins garantie, si l’on vaccine en hiver, on aura le maximum de l’efficacité au printemps.
Le vaccin semble peu efficace pour empêcher l’infection (peu d’effet sur la charge parasitaire) ; en revanche, l’anémie (mesurée par la baisse de l’hématocrite) et les signes cliniques (mesurés par un score clinique prenant en compte, entre autres, l’état général, la température, la taille de la rate…) ont été significativement moins marqués chez les chiens vaccinés que chez les chiens non vaccinés. L’anémie était par ailleurs d’autant plus faible, que le taux d’anticorps induits par la vaccination était élevé. Il semble donc que la vaccination contre la babésiose soit peu efficace pour empêcher le chien d’attraper la maladie, mais que les animaux vaccinés fassent moins de symptômes, voire puissent guérir sans traitement. Une restriction quand même : le vaccin a été conçu avec une souche de Babesia canis… et l’effet favorable sur l’hématocrite et le score clinique est significativement réduit lorsque c’est une souche différente qui infecte le chien.
Le vaccin devra donc être considéré comme une protection de deuxième ligne, pour diminuer la sévérité d’une piroplasmose transmise par une tique qui aurait réussi à se faufiler malgré l’effet répulsif et acaricide des produits envisagés plus haut. L’intérêt de la vaccination devra être évalué en fonction de la fréquence de la piroplasmose dans la région, et du mode de vie du chien : à discuter avec votre vétérinaire.
Quelques mots enfin sur la chimioprévention : l’imidocarb, utilisé classiquement pour le traitement de la piroplasmose, a un effet rémanent dans l’organisme, et assurerait donc une protection contre l’infection pendant 4 à 6 semaines après une injection unique selon le RCP du médicament, pendant 2 semaines selon une étude espagnole. Cette chimioprévention peut être utile, notamment, pour un chien qui risque d’être particulièrement exposé pendant quelques semaines : voyage dans une région très infestée, avant une période de chasse… Là aussi, à discuter avec votre vétérinaire.
Et nous, dans tout ça ?
Alors avant tout, ni Babesia canis, ni Babesia vogeli ni Babesia gibsoni n’infectent les humains : zéro zéro zéro risque d’attraper la piroplasmose en papouillant votre chien malade ! Entre le chien et nous, ce ne sont ni les mêmes babésies, ni les mêmes tiques.
Chez l’humain, la babésiose est due essentiellement à Babesia divergens en France, et Babesia microti en Amérique du Nord. En Europe, les rongeurs constituent le réservoir naturel principal de la maladie, et le principal vecteur est Ixodes ricinus : on attrape la babésiose en se promenant dans les bois, et en se faisant mordre par une tique infectée. Les analyses sérologiques réalisées en France chez des personnes mordues par des tiques, positives pour la maladie de Lyme ou présentant des symptômes évocateurs, indiquent que plus d’un tiers de ces patients ont été au contact de Babesia divergens ; mais la PCR, très rarement positive, montre que très peu de patients en sont encore porteurs, les personnes immunocompétentes éliminant naturellement le parasite sans avoir présenté de symptôme, ou seulement des symptômes légers. En revanche, les patients immunodéprimés, âgés ou ayant fait l’objet d’une ablation de la rate peuvent présenter un tableau clinique plus sévère.