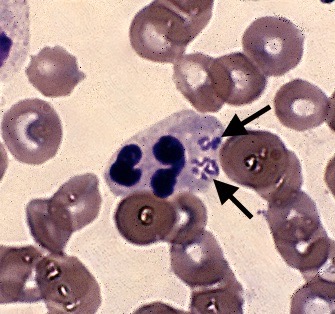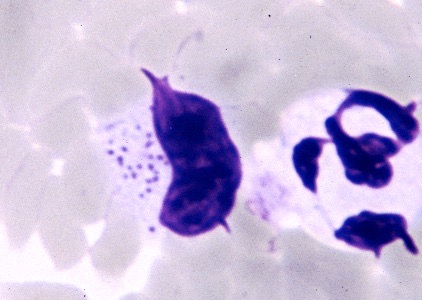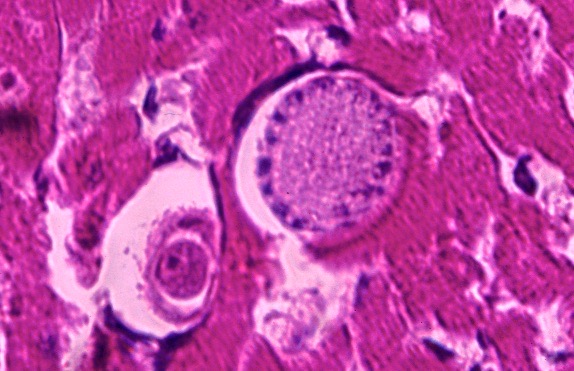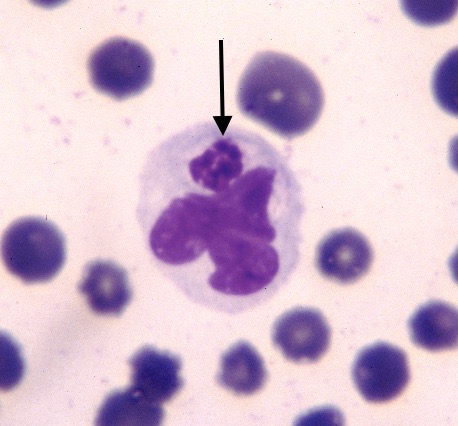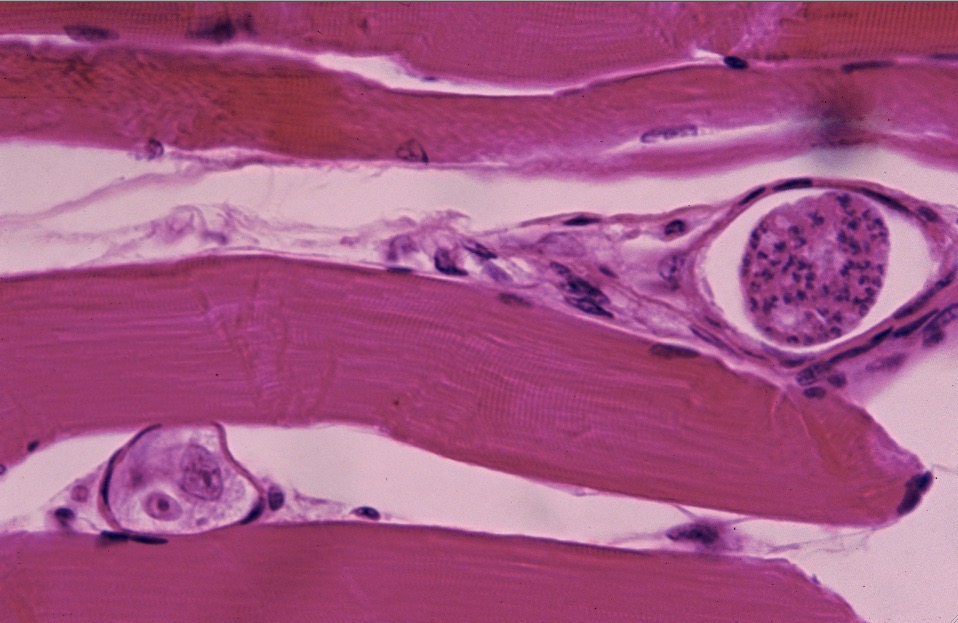
Deux schizontes d’Hepatozoon felis, au milieu des fibres musculaires d’un chat.
Maladie vectorielle ? vous avez dit, maladie vectorielle ?
Une petite définition, pour commencer : les maladies (à transmission) vectorielles sont des maladies bactériennes, virales ou parasitaires transmises par… des vecteurs, essentiellement insectes et acariens hématophages – autrement dit, suceurs de sang : tiques, puces, moustiques, phlébotomes… malheureusement pas vampires – quoique.
Parmi les maladies vectorielles, certaines ne concernent que les animaux (par exemple, la babésiose = piroplasmose du chien, due à Babesia canis), d’autres peuvent passer de l’animal à l’humain, et réciproquement. Chez l’Homme, tout le monde a entendu parler du paludisme, de la maladie de Lyme, du chikungunya ou… de la peste ! Chez le chien, la piroplasmose déjà citée, ou la leishmaniose, sont également des noms qui parlent (à peu près) à tout le monde, et par ailleurs des maladies fréquentes. En revanche, le chat (tant mieux pour lui !), semble peu réceptif aux maladies vectorielles transmises par les tiques, puces, et autres « moustiques ». L’hémobartonellose, rebaptisée il y a quelques années mycoplasmose (le progrès fait rage), mérite d’être détaillée. L’ehrlichiose est plus rare, mais nous en avons tout de même rencontré plus de vingt-cinq cas. Hépatozoonose, anaplasmose, piroplasmose, leishmaniose, dirofilariose… sont beaucoup plus confidentielles, au moins dans notre région.
Petit tour d’horizon, donc, de ces différentes maladies : c’est parti !
Deux des principaux vecteurs de maladies vectorielles chez le chat : à gauche, Ctenocephalides felis, reconnaissable à la forme oblongue de sa tête et à la longueur des dents du peigne de sa joue (= cténidie génale). A droite : une tique femelle bien gorgée et solidement plantée sur l’encolure d’un chat : il s’agit probablement d’une tique de l’espèce Rhipicephalus sanguineus.
La mycoplasmose (ex-hémobartonellose)
L’agent infectieux anciennement appelé Haemobartonella felis est une bactérie gram-négatif polymorphe (de forme tantôt ronde, en anneau ou en batonnet), que l’on observe à la surface des globules rouges du chat. Sa classification a été modifiée il y a quelques années, au vu de sa séquence génétique. Les petites formes d’H. felis s’appellent maintenant Mycoplasma haemominutum, et les grandes formes, généralement plus pathogènes, ont pris le nom de Mycoplasma haemofelis.
Les chats mâles, vivant à l’extérieur, seraient plus souvent infectés. On pense que les mycoplasmes sont transmis de chat à chat lors de piqûres d’insectes ou d’acariens (puces, moustiques, tiques…), et par morsure ou griffure lors des bagarres, sans que ce cela soit formellement démontré. Une transmission de la chatte au chaton est probable, mais son mécanisme est inconnu. Expérimentalement, le sang infecté transmet le mycoplasme par voie intra-veineuse, (donc par transfusion sanguine), et par voie orale (d’où le rôle possible des bagarres). Un stress ou une maladie intercurrente, (infection par les virus FeLV ou FIV, notamment), favorisent le développement de la maladie, mais ne sont pas indispensables : la mycoplasmose ne peut pas être considérée comme une simple infection opportuniste. Plusieurs auteurs rapportent cependant des pourcentages élevés, (supérieurs à 40 %), de chats infectés à la fois par un mycoplasme et par le FeLV et/ou le FIV. Dans notre expérience personnelle, les chats que nous avons trouvés infectés par des mycoplasmes dans les environs de Sommières et de Calvisson, étaient pratiquement toujours négatifs pour le FeLV et le FIV.
Le taux de mycoplasmes dans le sang évolue de façon cyclique, inversement à la quantité de globules rouges. Les micro-organismes peuvent parfois disparaître du sang en moins de deux heures. Lorsque les mycoplasmes adhèrent à la surface d’un globule rouge, ils provoquent des lésions de sa membrane, augmentant sa fragilité, et exposant des antigènes membranaires : ceci provoque une anémie, par destruction directe, par des mécanismes immunitaires, et par séquestration des globules rouges infectés.
La période entre l’infection et l’apparition des bactéries dans le sang (et les premiers symptômes) dure de 2 à 21 jours dans les conditions expérimentales. Les signes cliniques – quand il y en a, car de nombreux chats sont porteurs sains – sont peu spécifiques : abattement, anorexie, amaigrissement, vomissements… plus évocateur : des muqueuses pâles et parfois ictériques (jaunisse), de la fièvre, et une augmentation de taille de la rate.
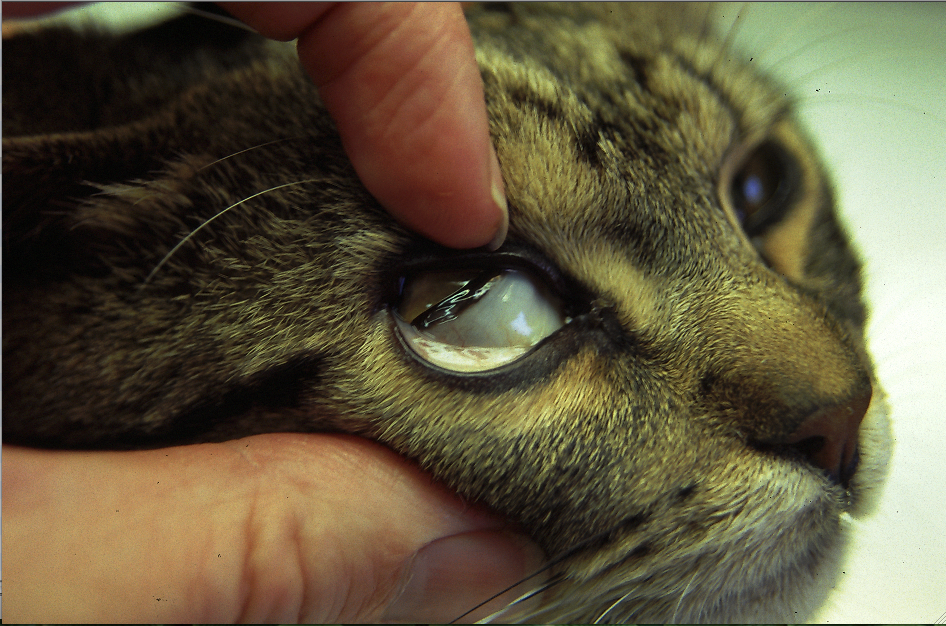
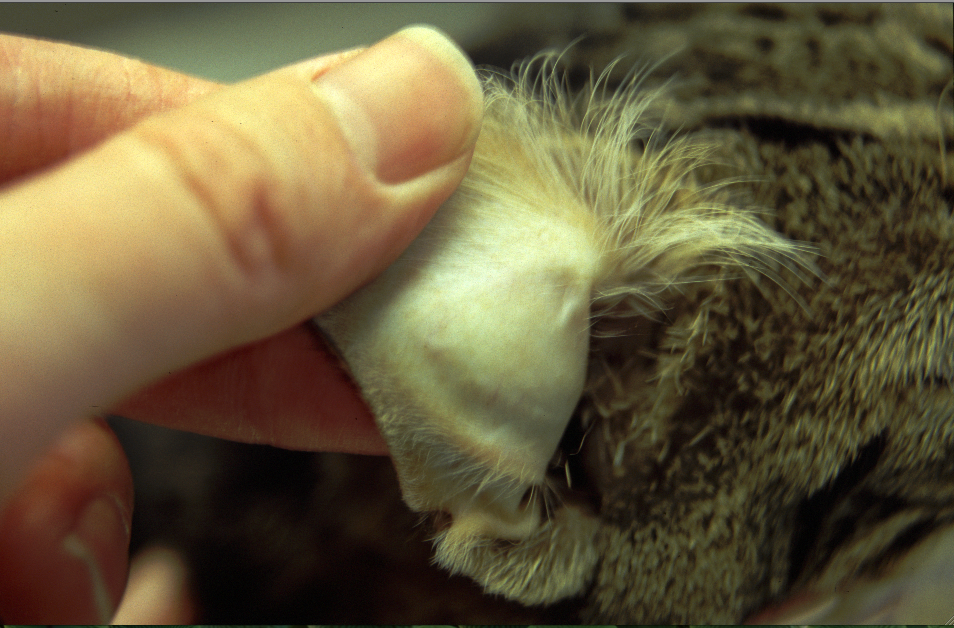
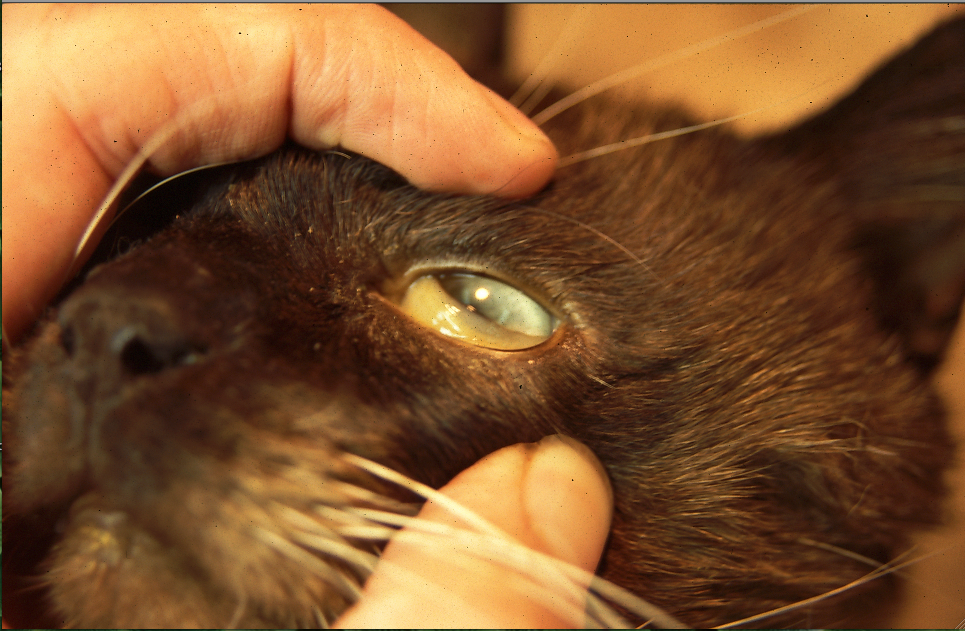
Photos du haut : pâleur des muqueuses (conjonctives oculaires et corps clignotant) et de la peau (ici au niveau de l’oreille). Ci-dessus : ictère (jaunisse), visible au niveau des muqueuses oculaires et buccales. Ces deux chats étaient infectés par Mycoplasma haemofelis, et ont bien répondu au traitement dont nous parlerons plus loin.
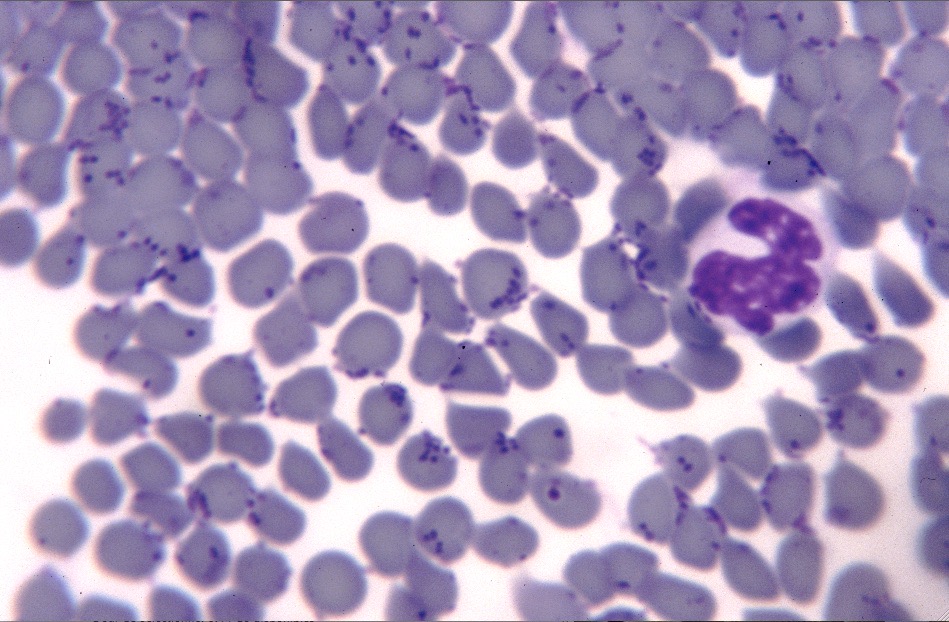
Parmi les signes biologiques observés, on note une anémie souvent régénérative (mais pas toujours, notamment dans les tout premiers jours de l’anémie, et en cas de co-infection par le FeLV). On peut observer des macrophages « mangeant » des globules rouges, et le test de Coombs (qui indique une destruction des globules rouges par un mécanisme immun), est souvent positif. Les mycoplasmes sont visibles à la surface des globules rouges sous la forme de coques, de bâtonnets ou d’anneaux mesurant 0,5 à 1 µm en moyenne, mais la bactérie n’est présente dans le sang que de façon cyclique, moins de 50 % du temps.
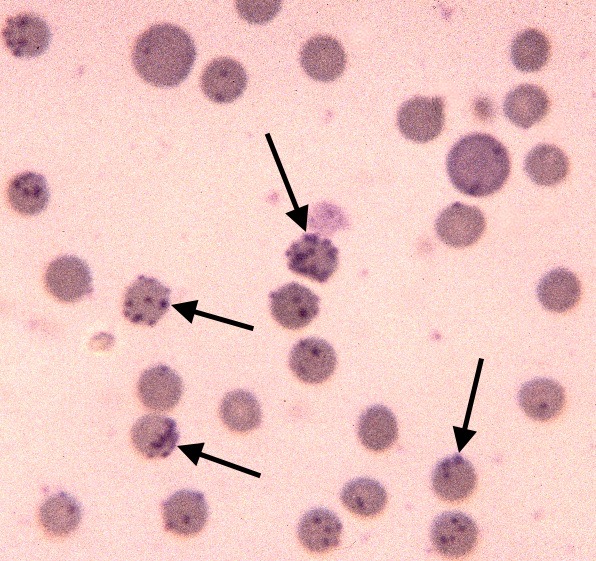
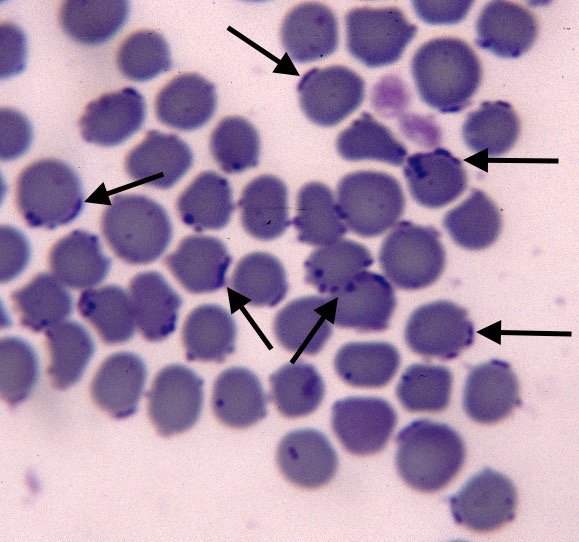
Photos ci-dessus : Des hémobartonelles (pardon, des mycoplasmes) absolument partout, sur les frottis sanguins de ces deux chats : rares sont les hématies (= globules rouges) qui n’en ont pas, et certaines en sont absolument couvertes ! à gauche, plutôt des formes de coques ou en anneaux (on les devine sur la photo, mais sur le frottis sanguin, ça faisait vraiment des anneaux !). A droite, les mycoplasmes ont des formes de coques ou de bâtonnets.
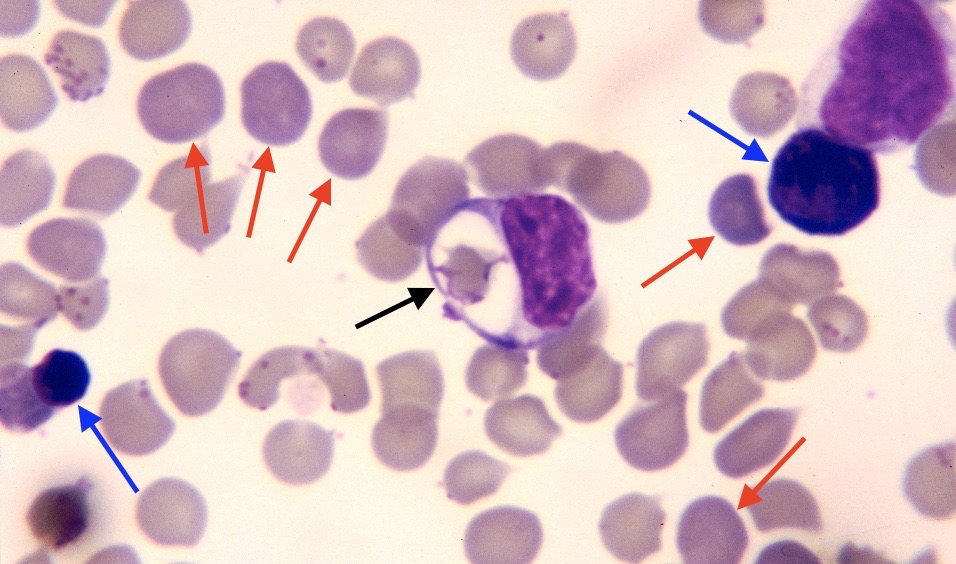
Photo ci-dessus : on vous parlait de globules rouges qui se font manger… en voici un bel exemple (flèche noire) ; on n’en est qu’au début du processus de phagocytose, l’hématie est encore bien reconnaissable ! Ici, les mycoplasmes sont moins nombreux et moins voyants que sur les photos du dessus, encore qu’en haut à gauche, on a une hématie bien recouverte, et d’autres à gauche ou au centre de l’image ne sont pas mal non plus. Autre particularité de cette photo, qui n’était pas présente sur les images précédentes : une polychromatophilie-anisocytose, c’est à dire que les hématies sont de différentes tailles, et de différentes couleurs. Cela témoigne des efforts de l’organisme pour remplacer les hématies détruites par les mycoplasmes, en larguant dans la circulation ce qu’il a sous la main, à savoir des hématies pas tout à fait finies : réticulocytes, plus basophiles (= violets) que les autres globules rouges (flèches rouges), et même des hématies encore plus primitives puisqu’ayant encore un noyau (érythroblastes : flèches bleues).
Le diagnostic se fait par simple examen d’un frottis sanguin, ou par identification génétique (PCR). Quand on a des mycoplasmes absolument partout, comme sur les photos ci-dessus, le diagnostic ne pose pas trop de problèmes. Mais il y a des fois où la reconnaissance des mycoplasmes sur le frottis sanguin est rendue difficile par le caractère cyclique de la bactériémie, et par la difficulté de distinguer les mycoplasmes d’un certain nombre d’autres granulations qui peuvent être présentes à la surface des globules rouges : débris de noyau, grain d’hémoglobine, résidu de colorant… Deux exemples ci-dessous :
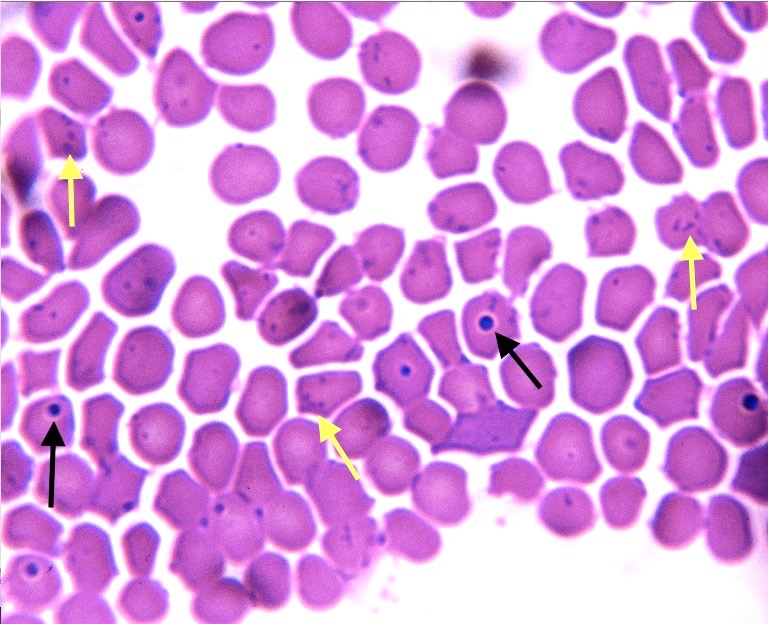
Mycoplasme, ou pas mycoplasme ? Photo de gauche : nombreux granules d’hémoglobine dans les globules rouges d’un chat infecté par le FeLV. L’aspect régénératif des globules rouges évoque aussi une mycoplasmose féline… mais ce n’est pas une mycoplasmose : la taille des grains est beaucoup trop hétérogène. A droite : là, pour le coup, on a bien des mycoplasmes (flèches jaunes), mais aussi des corps de Howell-Jolly (flèches bleues), qui sont des résidus de noyau (parce qu’on l’a vu plus haut, les globules rouges ont un noyau à un stade plus précoce de leur différenciation = érythroblastes). La photo permet de comparer, en mettant côte à côte les corps de Howell-Joly, un seul par cellule, de taille variable mais souvent plus gros, bien ronds et entourés d’un halo clair, et les mycoplasmes, petits grains de même taille et souvent disposés en groupes ou en chaînettes.
La PCR (Polymérase Chain Reaction) est une technique de diagnostic génétique très sensible : dans une étude, elle a permis de détecter des mycoplasmes chez 14,5 % de chats tout-venant, sans aucun symptôme. La PCR permet aussi de distinguer Mycoplasma haemominutum (moins méchante) de Mycoplasma haemofelis (plus méchante), et de les quantifier : on peut ainsi déterminer si les symptômes du chat sont probablement dûs à la présence des mycoplasmes (M. haemofelis en grande quantité), ou s’il faut chercher autre chose (M. haemominutum en faible nombre). La PCR permet enfin de s’assurer de la disparition des bactéries après traitement.
Le traitement, justement, fait appel à un antibiotique, la doxycycline, éventuellement à l’enrofloxacine, mais cette dernière uniquement quand il n’existe aucune autre option, vu qu’il s’agit d’un antibiotique « de réserve », pouvant être à l’origine de résistances bactériennes chez l’humain. Les chats traités par l’une de ces deux molécules guérissent plus rapidement que les témoins non traités, et dans notre expérience, la guérison clinique est habituellement définitive. Les mycoplasmes disparaissent généralement du frottis sanguin dès le début du traitement. En revanche, la PCR peut rester positive pendant le traitement, et si elle se négative, elle redevient généralement positive 3 à 35 jours après la fin des antibiotiques. Le pronostic clinique est donc bon en l’absence de maladie intercurrente, (infection par le FeLV ou le FIV, notamment). En revanche, le pronostic bactériologique est réservé, avec persistance fréquente de l’agent infectieux en dépit du traitement, et risque théorique de rechute (encore une fois, nous l’avons rarement – voire jamais – observé). En dehors du traitement antibiotique, transfusion, corticoïdes (pour l’anémie hémolytique à médiation immune), et différents médicaments adjuvants, peuvent être utilisés en fonction des symptômes.
L’ehrlichiose et l’anaplasmose
L’infection du chat par des Ehrlichia ou Anaplasma a été reconnue récemment, puisque le premier cas suspecté a été décrit par Charpentier et Groulade en 1986. Les études sérologiques, puis génétiques, ont montré que trois « Ehrlichiae » peuvent infecter le chat dans les conditions naturelles : Ehrlichia canis qui infecte les lymphocytes et les monocytes, et que l’on rencontre dans notre région (transmission probable par la tique Rhipicephalus sanguineus), Anaplasma phagocytophilum, qui infecte les granulocytes et que l’on rencontre un peu plus au nord, (transmission par la tique Ixodes ricinus, qui vit au nord de la bordure méditerranéenne), et Neorickettsia risticii, essentiellement décrite en Amérique du nord.
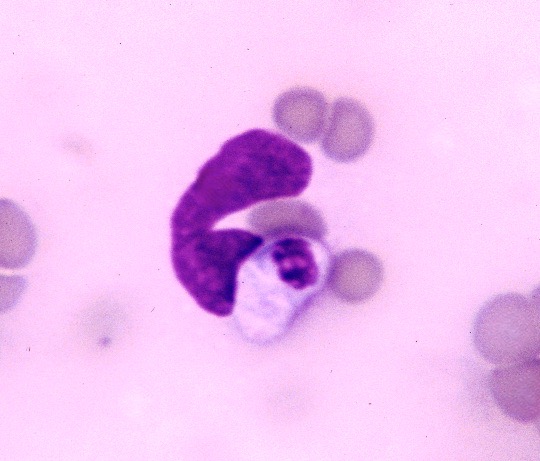
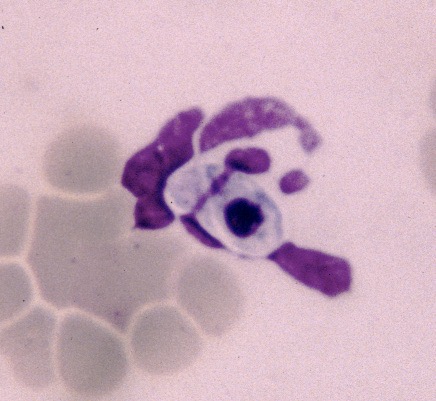
Ci-dessus à gauche : inclusion ressemblant aux morulas d’Ehrlichia canis rencontrées chez le chien, dans une cellule mononucléée chez un chat très séropositif pour Ehrlichia canis. A droite : morula d’Anaplasma phagocytophilum dans un polynucléaire neutrophile (Photo Pr Egenvall, que nous remercions).
Une revue a regroupé trente et un cas publiés dans la littérature : les signes cliniques observés étaient la fièvre, l’anorexie, l’abattement, une perte de poids, des douleurs (notamment articulaires et cervicales), une pâleur des muqueuses, et plus rarement des difficultés respiratoires, et une rate de taille augmentée. L’anémie et l’hyperglobulinémie étaient les anomalies biologiques les plus souvent rencontrées. Le diagnostic s’appuyait sur une sérologie positive ou sur la présence de morulas dans les globules blancs du sang (morula = inclusion en forme de mûre, constituée d’un amas de parasites), sur une clinique et des examens complémentaires compatibles avec une infection par une Ehrlichia, sur l’exclusion des autres causes possibles, et sur la réponse à un traitement habituellement actif sur les rickettsies. 28 des 31 chats ont répondu à un traitement par la doxycycline et/ou l’imidocarb dipropionate (deux injections à 14 jours d’intervalle).
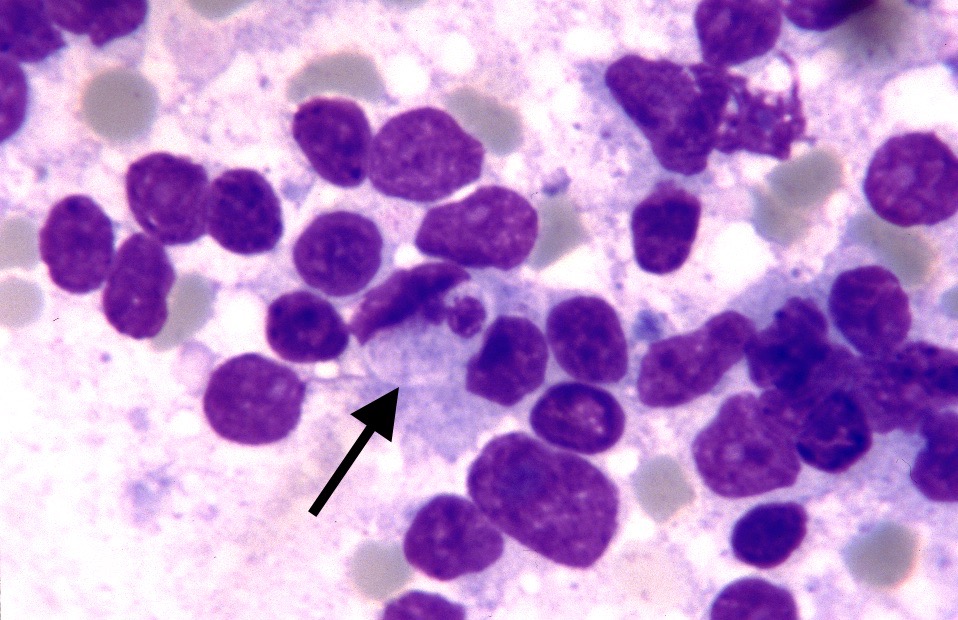
Dans les environs de Sommières et de Calvisson, nous avons observé 24 cas d’ehrlichiose féline entre 1994 et 2000. (Entre 2000 et 2024, nous n’avons plus observé que quelques rares cas, cette diminution étant commune à toutes les maladies transmises par les tiques dans la région, chez le chat comme chez le chien). 21/24 étaient négatifs pour le FeLV, et 13 étaient indemnes de toute maladie intercurrente. Les principaux symptômes observés chez ces 13 chats étaient l’anorexie et l’abattement dans presque tous les cas, l’amaigrissement et une fièvre > 40 °C chez la moitié d’entre eux, plus rarement des signes digestifs, respiratoires, et des douleurs articulaires. Les signes biologiques les plus fréquents étaient la présence d’inclusions cytoplasmiques dans les lymphocytes sur le frottis sanguin (photos ci-dessous), une baisse des plaquettes sanguines, et une augmentation des taux de protéines et de globulines. Le diagnostic de suspicion était fondé sur la clinique, et sur la présence d’inclusions cytoplasmiques – rarement de morulas – dans les cellules mononucléées (photos ci-dessous), mais ces inclusions n’étaient présentes que chez 13 de nos 24 chats (54 %). Par ailleurs, rien ne permettait d’affirmer que ces inclusions soient constituées d’Ehrlichia, et ne soient pas seulement une réaction des cellules à une infection chronique. Le critère de sélection pour les 24 cas a été une sérologie positive pour Ehrlichia canis. La PCR nous donne aujourd’hui un diagnostic de certitude, et permet en outre d’identifier l’espèce d’Ehrlichia en cause : du sang prélevé sur deux chats ehrlichiens des environs de Sommières a été envoyé au service du Pr Breitschwerdt, (Intracellular Pathogens Laboratory, North Carolina State University, USA), pour identification génétique. La séquence obtenue chez les deux chats a été identique à 100% à celle d’une souche vénézuellienne d’Ehrlichia canis, et semblable à 99% à deux souches nord-américaines d’Ehrlichia canis : il semble donc bien que ce soit l’Ehrlichia du chien (ou une bactérie extrêmement proche), qui infecte le chat, dans notre région.
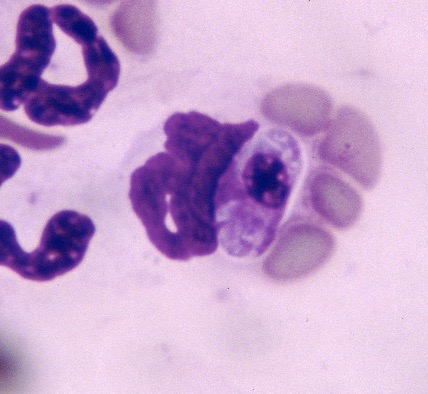
Ci-dessus : inclusions dans le cytoplasme de cellules mononucléées, chez deux chats infectés par Ehrlichia canis (avec des sérologies très positives). Les deux chats ont bien répondu au traitement.
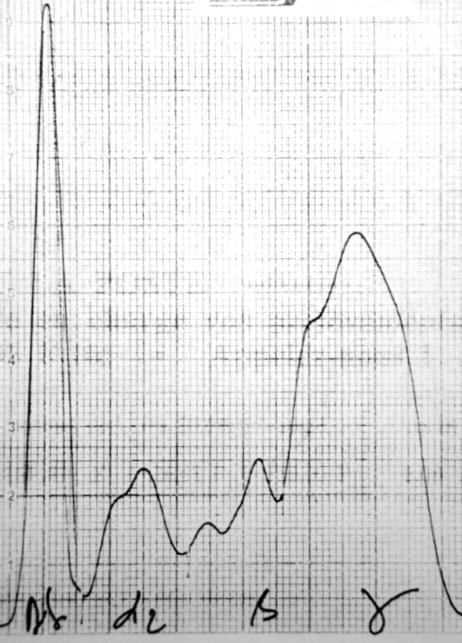
Ci-contre : électrophorèse d’un chat infecté par E. canis (pas très jolie, elle date des années 1990, mais on voit ce qu’on veut voir !) : le tracé est comparable à ce qu’on trouve chez les chiens ehrlichiens ou leishmaniens : forte augmentation des protéines totales (98 g/l), un bloc bêta-gamma (53 g/l), et un rapport albumine/globulines diminué, à 0,27.
Les 24 chats ont été traités par la doxycycline, et plus rarement par l’enrofloxacine (voir dans le paragraphe sur les mycoplasmoses les réserves quant à l’utilisation de cet antibiotique). L’arrêt du traitement était décidé en fonction de l’évolution de la sérologie, de l’électrophorèse des protéines, et/ou de la PCR. L’évolution clinique a été généralement bonne lorsque le chat n’était pas porteur d’une autre maladie grave. En revanche, la sérologie et/ou la PCR sont restées positives après plusieurs mois de traitement, chez 8 chats sur 13 qui ont pu être suivis à long terme, montrant ainsi la persistance de l’Ehrlichia en dépit d’un traitement long. Si le pronostic clinique est bon, le pronostic bactériologique de l’ehrlichiose féline apparaît donc réservé.
L’ehrlichiose féline est donc une infection rare, mais à laquelle il faut penser devant un chat présentant des signes de maladie générale sans cause évidente, et ne répondant pas à un traitement par un antibiotique autre que la doxycycline ou l’enrofloxacine. Les inclusions cytoplasmiques lymphocytaires constituent un signe d’appel intéressant. Le diagnostic est obtenu par sérologie, ou mieux, par PCR.
L’hépatozoonose féline
Les Hepatozoon sont de « gros » parasites, que l’on observe dans certaines cellules du sang (les polynucléaires neutrophiles). On retrouve le parasite sous une autre forme (les schizontes) à l’intérieur des muscles, y compris du muscle cardiaque (photo ci-dessous, et en tête de l’article). Hepatozoon canis infecte le chien, lorsque celui-ci mange une tique porteuse du parasite. Il est probable que le même mode de contamination existe (entre autres) chez le chat… mais cela n’a pu être démontré. Une transmission transplacentaire de la mère au fœtus, et par ingestion lorsque le chat mange une proie elle-même infectée, sont aussi suspectées.
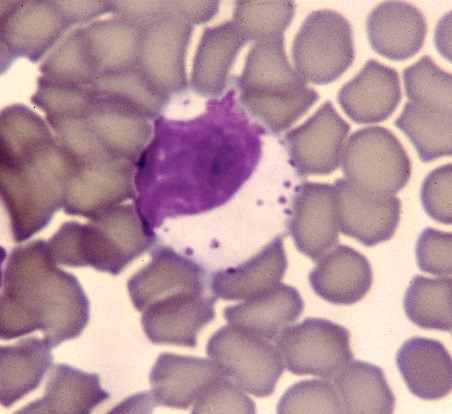
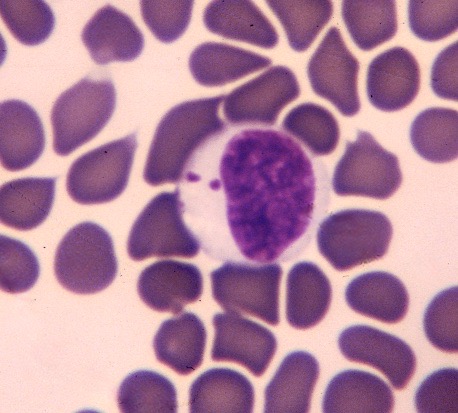
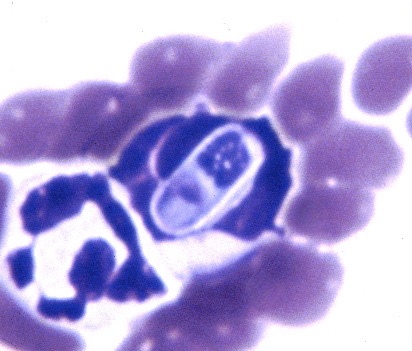
Un gamétocyte d’Hepatozoon felis (photo de gauche) et à droite, à titre de comparaison, un gamétocyte d’H. canis : la capsule d’H. canis a un aspect bien rectangulaire, alors que celle d’H. felis a plutôt une forme en haricot, et se distingue parfois difficilement du cytoplasme de la cellule hôte (photo ci-dessous à droite).
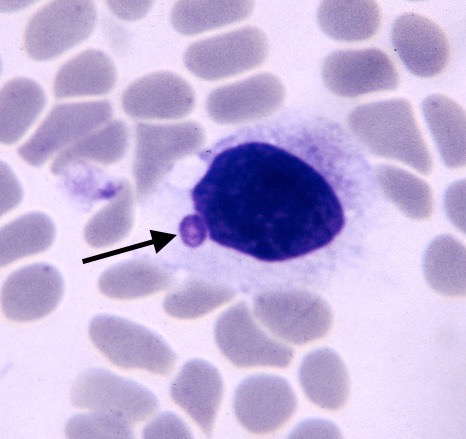
Deux endroits un peu plus inhabituels pour aller chercher des Hepatozoon de chat : à gauche, cytoponction d’un ganglion : le gamétocyte (flèche) se distingue à peine du cytoplasme de la cellule hôte. A droite : image d’histologie (voir aussi la photo en tête d’article) : deux schizontes d’Hepatozoon felis dans des fibres musculaires de chat.
Depuis la fin des années 1980, nous avons diagnostiqué environ 130 cas d’hépatozoonose chez le chien dans les environs de Sommières et de Calvisson (la plupart avant le milieu des années 2000), contre seulement 5 chez le chat. Quoique plus rare chez le chat que chez le chien, l’infection du chat par des Hepatozoon est malgré tout décrite en Inde, en Afrique du sud, au Nigeria, aux USA, au Brésil, en Israel, en Espagne, en Grèce, en Italie et donc, en France (et peut-être dans quelques autres pays qui nous ont échappé). Dans une étude réalisée en Israël sur 152 chats asymptomatiques, 55 (36%) ont été trouvés positifs par PCR pour Hepatozoon ; et en Grèce, ce sont 26% parmi 282 chats testés qui étaient positifs (dont seulement 13 avaient des gamétocytes sur le frottis sanguin). Donc, une infection pas très fréquente… mais quand même.
Nos cinq chats porteurs d’Hepatozoon présentaient tous une comorbidité, susceptible d’induire un déficit immunitaire : infection par le FeLV et/ou le FIV, chimiothérapie (pour un lymphome) et, concernant le dernier, une péritonite infectieuse féline (PIF). Du coup, difficile de définir des symptômes spécifiquement liés à l’infection par les Hepatozoons : nos cinq chats étaient généralement en mauvais état général avec un abattement, une anorexie, une anémie parfois très marquée… mais on peut penser que FeLV, FIV, lymphome ou PIF n’y étaient pas pour rien !
On l’a vu, les Hepatozoon mis en évidence chez les chats des environs de Sommières, étaient très peu nombreux sur les frottis sanguins, et ne ressemblaient pas à l’Hepatozoon canis du chien (voir les photos plus haut) : forme en haricot, capsule moins visible, cytoplasme granuleux… À ces différences morphologiques se sont ajoutées dans les années 2010 des différences génétiques, qui ont conduit à créer pour l’Hepatozoon du chat l’espèce Hepatozoon felis, différente d’Hepatozoon canis. Les Hepatozoon d’un chat vivant à proximité de Sommières ont été identifiés génétiquement comme étant des Hepatozoon felis, quasiment identiques (99 %) à ceux trouvés chez des chats en Espagne et en Israël (Pr Gad Baneth, Hebrew University, Rehovot, Israel). Ce qui n’empêche pas certains chats de se retrouver contaminés par Hepatozoon canis et même par une troisième espèce : H. sylvestris !
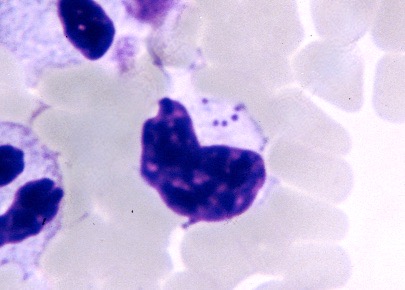
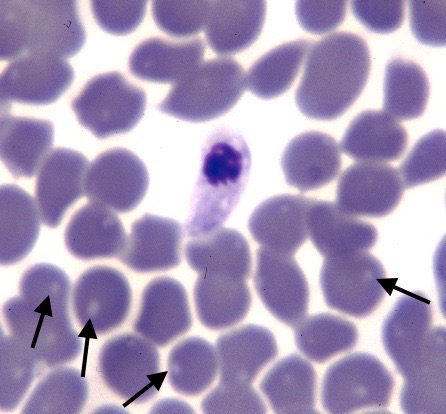
Hepatozoon felis dans tous ses états : en haut, deux gamétocytes bien typiques. Ci-dessus à gauche : un Hepatozoon qui s’est échappé de sa cellule et se promène tout seul dans le sang ! Noter la présence de corps de Heinz (particules d’hémoglobine dénaturée, a priori sans rapport avec la présence d’Hepatozoons), dans presque toutes les hématies (flèches). A droite : si on ne savait pas qu’il y a des Hepatozoons sur ce frottis et qu’on ne cherchait pas à en trouver toujours davantage, on serait sans doute passés à côté de celui-ci : on reconnaît bien son noyau (flèche), mais pour le reste…
Plusieurs molécules ont été utilisées pour traiter les chats infectés par Hepatozoon felis, (doxycycline, imidocarb…), mais toujours sur un faible nombre d’individus. Comme il semble, en outre, probable que le parasite provoque peu de symptômes chez le chat et que s’il y en a, ils soient plutôt dus à une maladie intercurrente plus méchante… l’intérêt du traitement apparaît tout relatif. En revanche, comme l’Hepatozoon semble s’installer à la faveur d’un déficit de l’immunité, sa découverte chez un chat incite à rechercher une maladie plus « sérieuse » : infection par le FeLV ou le FIV, mycoplasmose, tumeur…
La babésiose féline
Alors là, on va être bref et on ne vous montrera pas de photo… parce qu’on n’en a jamais vu. Ou plutôt, il nous est rarement arrivé de trouver, dans les hématies de chats fiévreux, de toutes petites inclusions en anneau qui auraient éventuellement peut-être possiblement etc pu être des Babesia de chat, genre Babesia gibsoni, mais il était impossible d’être affirmatif et comme à l’époque, on n’avait pas de PCR pour confirmer…
Donc, on se limitera à dire que différentes espèces de Babesia peuvent être responsables de l’infection chez le chat : le plus souvent, il s’agit de piroplasmes de petite taille (Babesia gibsoni, Babesia annae), mais certains cas sont probablement dus au piroplasme du chien, Babesia canis. Comme chez le chien, la transmission se fait par morsure d’une tique infectée. Les cas de babésiose féline sont exceptionnels en France.
Les symptômes sont l’abattement, l’anorexie, une fièvre, la pâleur des muqueuses, et une rate de taille augmentée. Le traitement n’est pas toujours efficace.
La leishmaniose féline
Alors, on passe maintenant aux parasites transmis par des insectes volants, en commençant par la leishmaniose.
Il y a un (long) article de ce site consacré à la leishmaniose, essentiellement chez le chien, mais avec à la fin un paragraphe, quand même assez fourni, sur la leishmaniose du chat, que nous reproduisons presque intégralement ici… mais il y a tout de même quelques éléments de plus dans l’article original.
Comme le chien et d’autres espèces vivant en zone d’endémie, le chat peut être infecté par Leishmania infantum. La transmission est également assurée par les phlébotomes, qui non seulement piquent les chats, mais peuvent également s’infecter sur des chats eux-mêmes infectés.
Jusqu’à (relativement) récemment, on croyait les chats peu concernés par la leishmaniose : en effet, au cours des 25 dernières années, seulement une centaine de cas de leishmaniose féline ont été rapportés en Europe, essentiellement en Italie, Espagne, France et Portugal. A titre de comparaison, c’est le nombre de chiens leishmaniens que nous trouvions en deux ans dans les années 1990, dans notre seule patientèle du Gard. Dans la moitié des cas décrits, le système immunitaire des chats leishmaniens était probablement déprimé par un traitement immunosuppresseur, ou par la présence concomitante d’une infection par le FeLV ou le FIV, ou d’une maladie débilitante.
Bon, le problème, c’est que ce n’est pas parce qu’on n’est pas malade qu’on n’est pas infecté. Une étude réalisée dans la région de Nice a montré une séroprévalence de 12% chez le chat vs 12,4% chez le chien. Dans un refuge en Israël, la séroprévalence (parmi des chats, il est vrai, en mauvais état), était même de 75%. Cependant, des PCR sur sang ont montré que seuls 16% des chats de ce refuge (ce qui est encore pas mal), avaient des leishmanies en circulation.
Les symptômes, chez les chats, sont assez semblables à ceux rencontrés chez le chien : il s’agit en premier lieu de lésions cutanéo-muqueuses généralement symétriques, notamment sur la face : oreilles, paupières, nez, lèvres ; on y observe des dépilations (sur les oreilles), des croûtes, des nodules, des ulcères… On peut retrouver de telles lésions aux extrémités des membres. Une hypertrophie des ganglions est également fréquente. Les symptômes généraux (abattement, anorexie, amaigrissement, pâleur des muqueuses), oculaires (uvéites) et buccaux (nodules sous la langue ou sur les gncives, stomatite chronique), sont plus occasionnels. Fièvre, ictère, vomissements-diarrhées, jetage nasal et quelques autres sont franchement rares. Côté laboratoire, on décrit classiquement une hypergammaglobulinémie et une protéinurie, comme chez le chien. Une anémie non régénérative et une atteinte rénale sont plus rares.
Le diagnostic peut se faire par mise en évidence des leishmanies sur le calque d’une lésion, cutanée ou autre, ou sur une ponction de ganglion ou de moelle osseuse : là, pas de doute, on sait qu’elles sont là ! Le plus souvent, c’est quand même par sérologie (sur une prise de sang) que l’on fait le diagnostic, mais on peut aussi demander une PCR qui nous renseignera sur la présence effective des leishmanies dans le sang, les ganglions, la moelle osseuse, les lésions cutanées…
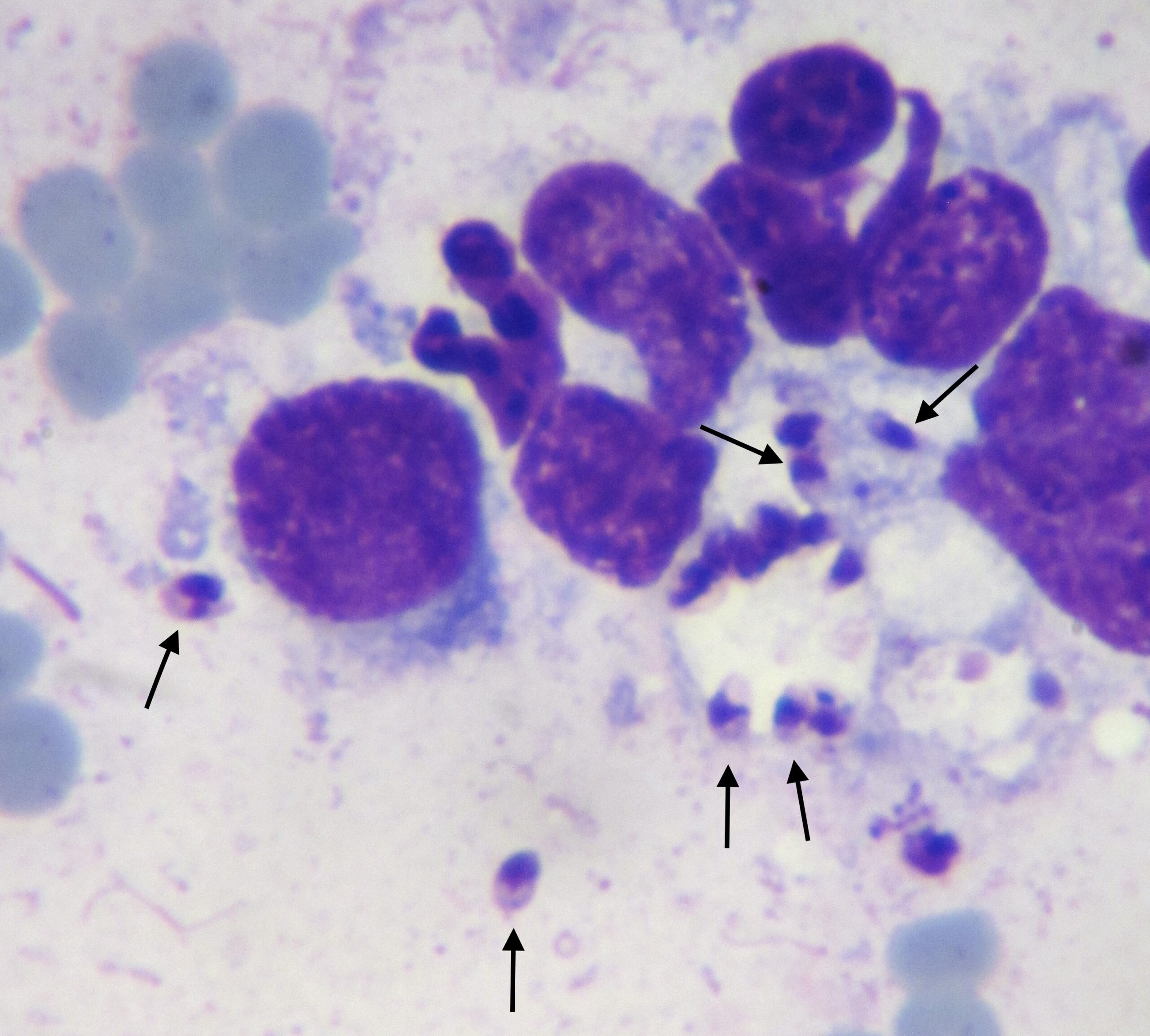
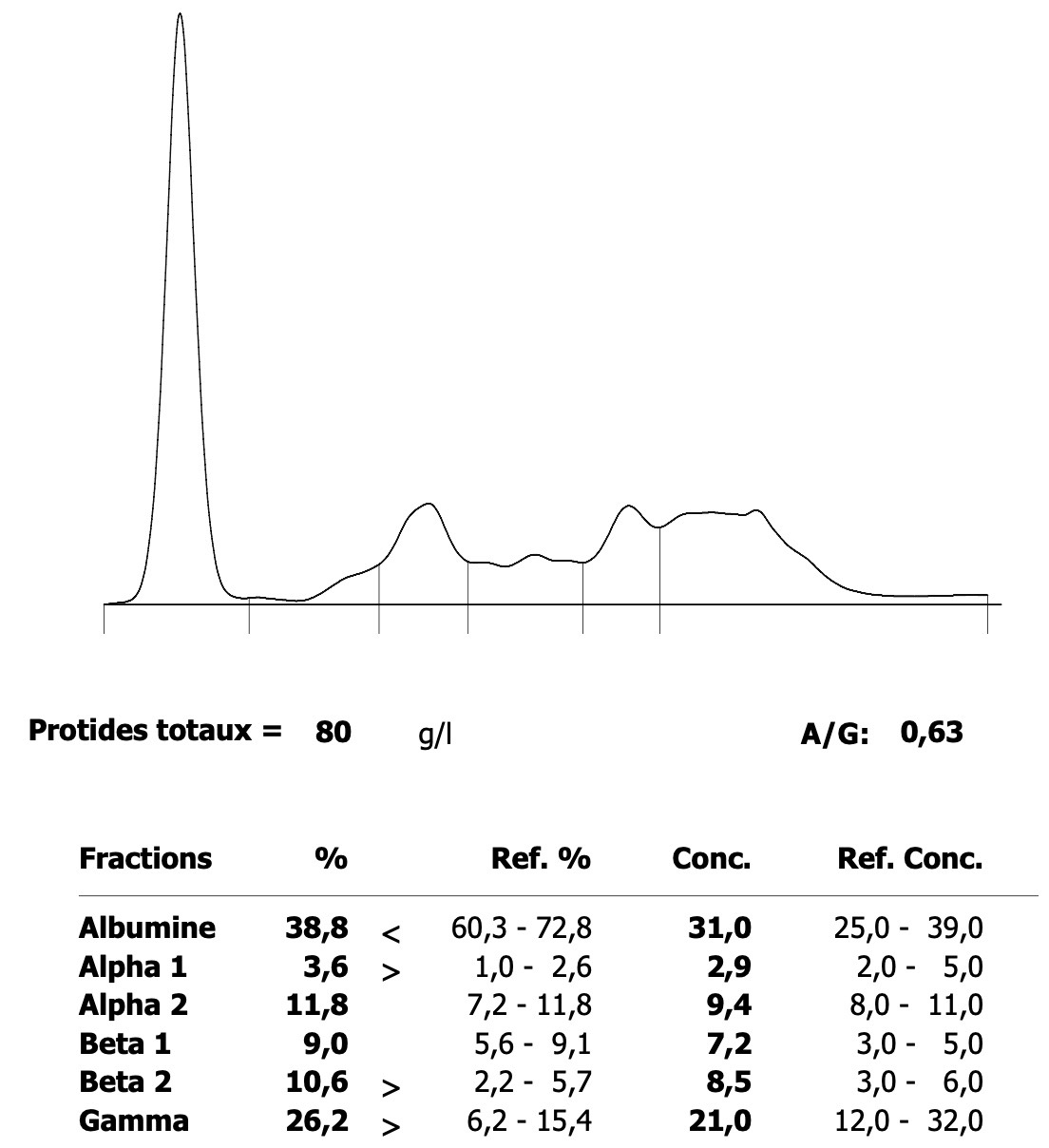
Photo de gauche : nombreuses leishmanies sur des calques réalisés sur une lésion proliférative dans la narine d’une chatte de 10 ans, référée pour saignement de nez : la seule fois en 40 ans que nous trouvions des leishmanies chez un chat, autant dire que ce n’est pas bien fréquent ! Malheureusement pour la petite chatte, les leishmanies n’étaient probablement arrivées là qu’en profitant d’une immunité déprimée : la sérologie pour le virus de l’immunodéficience féline (FIV) était positive, et le diagnostic histologique pour la masse dans la narine a été lymphome d’immunophénotype B diffus, à grandes cellules. Aucun symptôme imputable à la leishmaniose n’était présent. A droite : électrophorèse des protéines de la même chatte, montrant une augmentation modérée des globulines, en pic en bêta et polyclonale en gamma, en relation avec la leishmaniose… et/ou le lymphome ?
Concernant le traitement, pas d’étude contrôlée, pas de consensus : on fait à vue de nez, en extrapolant au chat ce qui se fait chez le chien, et apparemment, ça marche pas mal et c’est plutôt bien supporté. Donc allopurinol (surtout), GLUCANTIME® (moins souvent et quand les reins sont d’accord), et éventuellement les deux.
La dirofilariose féline
Dirofilaria immitis est un ver transmis par piqûre de moustique, et qui vit dans le cœur droit et les artères pulmonaires des chiens – occasionnellement des chats. En France métropolitaine, le parasite n’est présent que dans des zones très localisées : Camargue, pourtour de l’étang de Berre, Corse…
Comme pour la plupart des autres maladies vectorielles, les chats sont moins réceptifs que les chiens à la dirofilariose : on estime que dans une région donnée, le taux d’infestation des chats représente 5 à 20 % de celui des chiens (5 à 20 fois moins de chats infestés que de chiens, dans une région donnée).

Chez le chien, la plupart des jeunes vers deviennent des adultes qui vivront 5 à 7 ans. Chez le chat, la plupart des jeunes vers meurent, et seule une minorité devient adulte et vivra entre 2 à 4 ans.
Les chats infectés ne présentent souvent aucun symptôme. Lorsqu’il y en a, ils apparaissent souvent tardivement (des mois, voire des années après la contamination), et consistent alors en un essoufflement, une toux, des vomissements chroniques, un état d’abattement… et parfois une détresse respiratoire et une mort subite chez un chat jusque là en bonne santé apparente, du fait d’une thrombo-embolie pulmonaire, d’une hémorragie due à la rupture d’une artère pulmonaire, voire d’un choc anaphylactique dû à la libération massive d’antigènes à la mort d’une filaire adulte. Mais ce n’est pas là l’évolution la plus fréquente !
Le diagnostic est difficile : chez le chien, on repère souvent les microfilaires (les larves des filaires adultes), sur un simple frottis sanguin – même si leur présence dans le sang n’est pas toujours détectable (voir l’article de ce site consacré aux filaires). Chez le chat, vu qu’il n’y a souvent qu’une seule filaire adulte dans le cœur, parfois deux (qui peuvent être de même sexe), la production de larves est forcément aléatoire ! De plus, ces microfilaires ne persistent généralement qu’un ou deux mois dans l’organisme, avant d’être éliminées par le système immunitaire du chat. Nous avons tout de même réussi à trouver une fois des microfilaires chez un chat, qui plus est dans ses urines ! (Urines contaminées par du sang – le chat souffrant de cystite – ce qui a probablement permis aux microfilaires d’arriver jusque là).
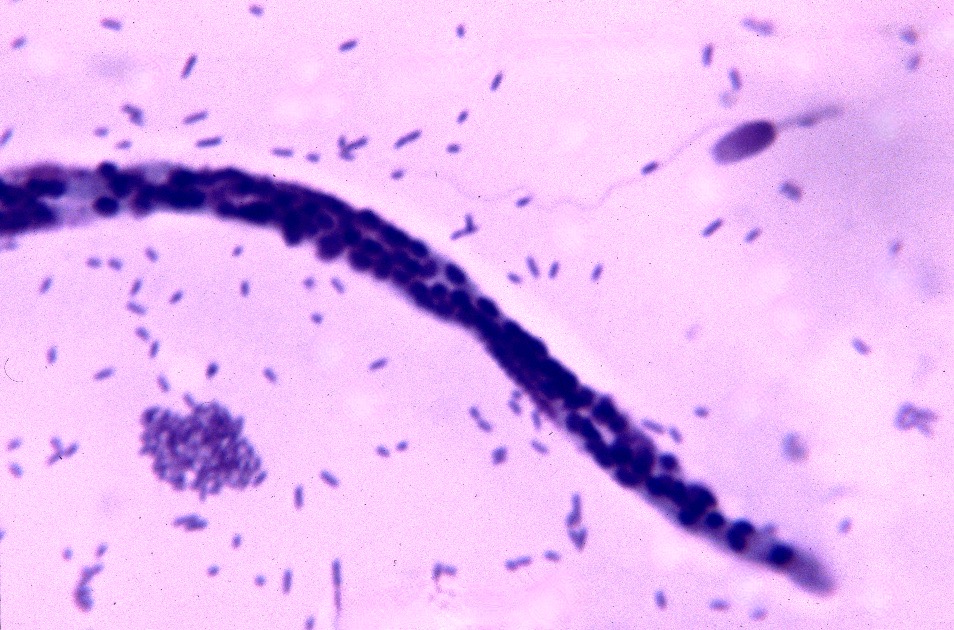
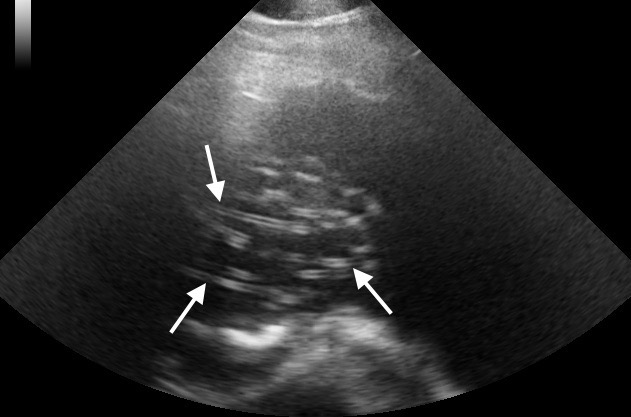
Photo de gauche : outre la partie antérieure de la microfilaire, on observe sur cette photo de nombreux bacilles et… un spermatozoïde (dans l’angle en haut à droite de la photo), qui prouvent que c’est bien dans les urines d’un chat (présenté pour une occlusion urétrale) que cette microfilaire prenait son bain ! Il y avait plusieurs microfilaires dans notre prélèvement, probablement arrivées là avec le sang de la cystite. La microfilaire a été identifiée dans un laboratoire vétérinaire, sur des critères morphologiques, comme étant probablement une larve de Dirofilaria immitis. (La PCR n’existait pas encore, à l’époque). L’analyse de selles du chat a, en outre, montré la présence d’œufs d’ankylostomes. A droite : il ne s’agit pas d’un cœur de chat, mais c’est histoire d’illustrer le diagnostic échographique de dirofilariose, ici chez un chien dont le frottis sanguin grouillait de microfilaires : chacune de ces petites lignes parallèles dans le ventricule droit du chien correspond à un segment de filaire adulte.
La sérologie donnant elle aussi des résultats aléatoires, l’échographie semble le moyen de diagnostic le plus sensible pour détecter les filaires adultes dans les artères pulmonaires du chat.
Aucun traitement visant à éliminer les vers adultes n’a montré sa capacité à augmenter la durée de vie des chats infestés : les traitements ne visent donc qu’à améliorer les symptômes (notamment respiratoires)… lorsqu’il y en a ! Mais comme on a vu que les filaires vivent moins longtemps chez le chat que chez le chien, et qu’en plus elles ne sont pas très nombreuses, le jour où elles meurent de leur belle mort, eh bien le chat s’est guéri tout seul ! A condition, on l’a vu, que la mort de la filaire ne provoque pas la mort subite du chat, par un choc anaphylactique.
La prévention est importante pour les chats vivant (ou voyageant) dans les zones à risque, inutile en dehors. On pourra utiliser notamment la milbémycine en comprimés, ou la sélamectine et la moxidectine en spot-on. Des répulsifs pour les moustiques seront bien sûr intéressants. La prévention de la dirofilariose ne présente pas d’intérêt dans les environs de Calvisson ou de Villevieille. En revanche, elle est conseillée si l’on amène son chat en Camargue, autour de l’étang de Berre, en Corse… et dans certaines régions d’Espagne, d’Italie, ou des DOM : n’hésitez pas à nous demander conseil.